
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑3] 书写离子方程式有哪些规则? 作者:黄元 来源:未知 日期:2012-05-21 14:40:26 点击:6693 所属专题:离子方程式书写
[注解与辨疑3] 书写离子方程式有哪些规则? 作者:黄元 来源:未知 日期:2012-05-21 14:40:26 点击:6693 所属专题:离子方程式书写
(1)固体间反应(不是熔融状态),虽然是电解质,但在书写离子方程式时,只能写化学式。一种物质为可溶的固体电解质,放在另一溶液中,此固体电解质仍写成“分子”形式。例如, 2NH 4 Cl(固)+Ca(OH) 2 (固) CaCl 2 +2NH 3 ↑+2H 2 O 2NaCl(固)+H 2 SO 4 (浓) Na 2 SO 4 +2HCl...
 [注解与辨疑3] 谈硫酸根离子的检验 作者:程新 来源:未知 日期:2012-05-13 22:37:51 点击:7503 所属专题:硫酸根离子 离子检验
[注解与辨疑3] 谈硫酸根离子的检验 作者:程新 来源:未知 日期:2012-05-13 22:37:51 点击:7503 所属专题:硫酸根离子 离子检验
检验某未知溶液中是否含有SO 4 2- ,涉及到试剂选择和操作程序两个关键点的科学配合。因为,除应考虑Ag + 的常规干扰外,还必须考虑Pb 2+ 、 如向某未知溶液中滴加BaCl 2 溶液,有白色沉淀产生,再加入HCl或HNO 3 沉淀不溶解,便断定该溶液中含有SO 4 2- 。 而溶液若含有Ag +...
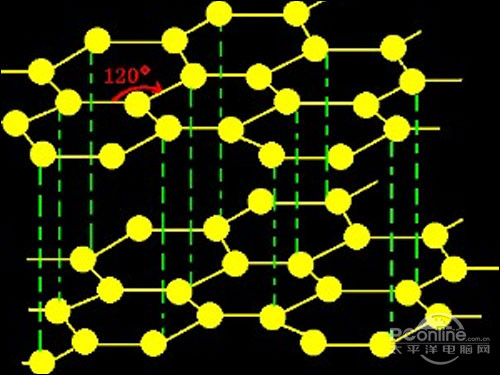 [注解与辨疑3] 在离子方程式的书写中以什么依据规定物质写离子的形式还是写化学 作者:祝其君 来源:未知 日期:2012-04-28 08:34:55 点击:5310 所属专题:离子方程式书写
[注解与辨疑3] 在离子方程式的书写中以什么依据规定物质写离子的形式还是写化学 作者:祝其君 来源:未知 日期:2012-04-28 08:34:55 点击:5310 所属专题:离子方程式书写
依据是决定于物质在环境中的主要存在形式,如氯化钠在熔融状态下主要存在形式是氯离子与钠离子,所以氯化钠在这一状态下在离子方程式中要写成离子形式。又比如,碳酸钙在水中主要以碳酸钙的形式而不是以钙离子与碳酸根离子的形式存在,所以在离子方程式中碳酸钙要写化学式,...
 [注解与辨疑3] 高中化学之离子共存问题 作者:林飞 来源:未知 日期:2012-03-02 10:13:59 点击:12351 所属专题:离子共存
[注解与辨疑3] 高中化学之离子共存问题 作者:林飞 来源:未知 日期:2012-03-02 10:13:59 点击:12351 所属专题:离子共存
离子在溶液中能否大量共存,涉及到离子的性质及溶液酸碱性等综合知识。凡能使溶液中因反应发生使有关离子浓度显著改变的均不能大量共存。如生成难溶、难电离、气体物质或能转变成其它种类的离子(包括氧化一还原反应). 下面是离子间不能共存的几种情况: 1.由于发生复分解...
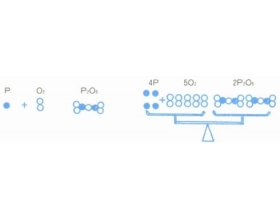 [注解与辨疑3] 化学方程式含义读法与书写 作者:马文礼 来源:未知 日期:2014-01-11 16:51:26 点击:13021 所属专题:化学反应方程式
[注解与辨疑3] 化学方程式含义读法与书写 作者:马文礼 来源:未知 日期:2014-01-11 16:51:26 点击:13021 所属专题:化学反应方程式
化学家用元素符号代表元素,用元素符号的组合——分子式代表各种各样的物质。我们把元素符号和分子式,分别比作英语中的字母和词汇。这比较清晰地表达了元素符号和分子式之间的关系。化学家正是依照这种思想,把分子式用适当的符号(如+,=)联结而成的句子来表示物质间...
 [注解与辨疑3] 高中化学离子共存问题常见误区 作者:刘明 来源:未知 日期:2012-03-01 18:48:15 点击:10060 所属专题:离子共存
[注解与辨疑3] 高中化学离子共存问题常见误区 作者:刘明 来源:未知 日期:2012-03-01 18:48:15 点击:10060 所属专题:离子共存
我们在书写化学方程式是会遇到很多的陷阱误区例如:题设情景,如酸碱性环境,无色透明溶液、产生气体、沉淀,发生氧化还原反应或复分解反应而不能共存, 这里还要注意以下几点: (1)、有些学生认为有色溶液不是“透明溶液”,这是错的。如果题设为无色透明溶液,则可排除含...
 [注解与辨疑3] “复分解反应条件之一是生成难溶物质”这句话对吗? 作者:蒋景耘 来源:未知 日期:2012-02-15 10:24:55 点击:2894 所属专题:复分解反应 条件
[注解与辨疑3] “复分解反应条件之一是生成难溶物质”这句话对吗? 作者:蒋景耘 来源:未知 日期:2012-02-15 10:24:55 点击:2894 所属专题:复分解反应 条件
新、旧教材在阐述复分解反应的条件时都是这样阐述的,其实这会给学生带来负面影响,不少学生甚至认为只有生成难溶物质才会有沉淀。其实只要溶质的量超过溶解度所允许值,不论难溶物质还是易溶物质都能沉淀,反应也就因此而发生了(学生往往把生成沉淀和析出晶体割离开来理解...
 [注解与辨疑3] 高中化学复杂电离方程式 作者:李文才 来源:未知 日期:2016-01-22 14:37:18 点击:4141 所属专题:电离方程式
[注解与辨疑3] 高中化学复杂电离方程式 作者:李文才 来源:未知 日期:2016-01-22 14:37:18 点击:4141 所属专题:电离方程式
两性氢氧化物: H + +AlO 2 - +H 2 O Al(OH) 3 Al 3+ +3OH - 强酸的酸式盐: NaHSO4==Na + +H + +SO 4 2- (水溶液) NaHSO4==Na + +HSO 4 2- (熔融状态) 弱酸的酸式盐: NaHCO 3 ==Na + +HCO 3 - 复盐: KAl(SO 4 ) 2 ==K + +Al 3+ +2SO 4 2- 络合物: Ag(NH 3...
 [注解与辨疑3] 过氧化钠在离子方程式中要拆开吗? 作者:许浩年 来源:未知 日期:2011-08-30 12:44:12 点击:6531 所属专题:过氧化钠 离子方程式书写
[注解与辨疑3] 过氧化钠在离子方程式中要拆开吗? 作者:许浩年 来源:未知 日期:2011-08-30 12:44:12 点击:6531 所属专题:过氧化钠 离子方程式书写
在水溶液中不能拆,因为固体的Na2O2中过氧根离子不能自由移动,所以不能拆,但在水溶液中没过氧根离子,过氧根离子遇水马上反应生成OH-和O2,所以就不存在过氧根离子在水溶液里,所以不能拆。但在熔融状态,没有水,Na2O2能电离出过氧根离子.完全电离.所以要拆.初中高中一般不讲熔融...
 [注解与辨疑3] 书写离子方程式时的“拆”与“不拆”问题 作者:袁建标 来源:未知 日期:2011-08-29 19:18:44 点击:14004 所属专题:离子方程式书写
[注解与辨疑3] 书写离子方程式时的“拆”与“不拆”问题 作者:袁建标 来源:未知 日期:2011-08-29 19:18:44 点击:14004 所属专题:离子方程式书写
写离子方程式时,强电解质一定拆,弱电解质一定不拆。水溶液中,强电解质在水中完全电离,所以肯定拆;而弱电解质不能完全电离,因此不拆。但是在非水溶液中进行时,或反应体系中水很少时,那就要看情况了。 在固相反应时,无论是强电解质还是弱电解质,无论这反应的实质是...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。预备知识 :要判断加入某物质后溶液溶液的导电性变化,核心是抓住溶液导电性的本质影...
离子方程式书写的核心难点之一,在于 “特殊物质的拆分判断”—— 部分物质因结构、溶...
电离方程式是表征物质在水溶液或熔融态电离过程的化学用语,常规强电解质(如 NaCl、HS...
离子方程式书写四大原则之一关键是拆分问题 1、 溶解性规律 常规 K + 、 Na + 、 NH 4...
1.警惕“颜色陷阱”: ①若限定溶液无色,则Cu 2+ 、Fe 3+ 、Fe 2+ 、Cr 2 O 7 2 ...
用化学式 和 离子符号等来表示物质离解成自由移动离子过程的式子叫做电离方程式。 书...
一句话总结:熔融态就是 固体加热熔化后的状态 。 在某个层面上,它和液态是一回事 (...
AgOH 是经常被忽略其存在的一种化合物,那是因为AgOH的热稳定性极差,室温就能分解,...