
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑3] 电解质与非电解质概念辨析 作者:化学自习室 来源:未知 日期:2019-11-11 17:42:36 点击:2146 所属专题:电解质判断
[注解与辨疑3] 电解质与非电解质概念辨析 作者:化学自习室 来源:未知 日期:2019-11-11 17:42:36 点击:2146 所属专题:电解质判断
在水溶液里或熔化状态下,化合物自身能否电离出离子是其能否导电的内因。因此对电解质概念作如下理解,即“凡是在水溶液或熔化状态下能够自身发生电离的化合物”有助于澄清错误认识。 (1) 金属(熔融导电)、Cl 2 (水溶液导电),但均非化合物,故 既不是电解质也不是非电...
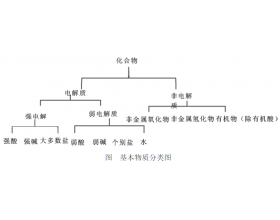 [注解与辨疑3] 认识电解质和非电解质 作者:陈兰芳 来源:未知 日期:2019-09-01 10:54:24 点击:10246 所属专题:电解质判断
[注解与辨疑3] 认识电解质和非电解质 作者:陈兰芳 来源:未知 日期:2019-09-01 10:54:24 点击:10246 所属专题:电解质判断
一、概念剖析是基础 电解质 :在水溶液里或熔融状态下能导电的化合物叫做电解质。 非电解质 :在水溶液里和熔融状态下都不能导电的化合物叫做非电解质。 1、从概念可以看出,电解质和非电解质的区别在于“或”与“和”,前者则表示,只需满足其中一个条件即可成立,即在水溶液...
 [基本概念] 79个常考的无机离子方程式总结 作者:王世坤 来源:未知 日期:2017-08-17 10:04:16 点击:2543 所属专题:离子反应方程式
[基本概念] 79个常考的无机离子方程式总结 作者:王世坤 来源:未知 日期:2017-08-17 10:04:16 点击:2543 所属专题:离子反应方程式
1、钠与水反应:2Na+2H 2 O══2Na + +2OH - +H 2 ↑ 2、钠与硫酸铜溶液:2Na+2H 2 O+Cu 2+ ══2Na + +Cu(OH) 2 ↓+H 2 ↑ 3、过氧化钠与水反应:2Na 2 O 2 +2H 2 O══4Na + +4OH - +O 2 ↑ 4、碳酸氢钠溶液与强碱溶液混合:HC O 3 - +OH - ══C ...
 [注解与辨疑3] 重要的与量有关的离子方程式的书写 作者:罗云峰 来源:未知 日期:2018-07-19 17:46:09 点击:1835 所属专题:离子方程式书写 定一法 过量与少量
[注解与辨疑3] 重要的与量有关的离子方程式的书写 作者:罗云峰 来源:未知 日期:2018-07-19 17:46:09 点击:1835 所属专题:离子方程式书写 定一法 过量与少量
1、与CO 2 (SO 2 )有关 (1)少量CO 2 通入NaOH溶液中 CO 2 +2OH - =C O 3 2 - +H 2 O (2)过量CO 2 通入NaOH溶液中 CO 2 +OH - =HC O 3 - (3)将过量的CO 2 通入NaAlO 2 溶液中 (4)将少量CO 2 通入苯酚钠溶液中 (5)漂白粉溶液与CO 2 2、酸式盐与碱的反应 (1)将少量N...
 [注解与辨疑3] 方程式中的气标与沉淀符号如何准确使用? 作者:康建峰 来源:未知 日期:2022-01-10 09:41:14 点击:21270 所属专题:离子方程式书写 化学反应方程式 规范
[注解与辨疑3] 方程式中的气标与沉淀符号如何准确使用? 作者:康建峰 来源:未知 日期:2022-01-10 09:41:14 点击:21270 所属专题:离子方程式书写 化学反应方程式 规范
在正确书写化学方程式或离子方程式时,气标与沉淀符号是方程式基本要素之一,但高中生对两种符号的准确使用认识还是很模糊,常常认为只要生成物中有气体产生或有难溶物生成,就一定要分别标注“↑”与“↓”符号,或经常漏标两种符号,造成辛辛苦苦写出的化学(或离子)方...
 [注解与辨疑3] 钙离子与碳酸氢根离子能大量共存吗? 作者:翟娜 来源:未知 日期:2016-05-12 20:58:19 点击:7454 所属专题:离子共存 碳酸氢钠01
[注解与辨疑3] 钙离子与碳酸氢根离子能大量共存吗? 作者:翟娜 来源:未知 日期:2016-05-12 20:58:19 点击:7454 所属专题:离子共存 碳酸氢钠01
有些离子不能大量共存,但在中学化学阶段 却误认为能大量共存,如从澄清石灰水中通入 CO 2 先有沉淀后溶解,就认为Ca 2+ 与HC O 3 - 能大量共存就是不对的。 将 0.05 mol/L CaCl 2 与 0. 50 mol/L NaHCO 3 两溶液相混合却发现可以生成CaCO 3 沉淀。理论上分析,当NaHCO 3...
 [注解与辨疑3] 酸式盐在化学反应中的规律 作者:傅芳 来源:未知 日期:2016-04-24 22:12:00 点击:5888 所属专题:酸式盐
[注解与辨疑3] 酸式盐在化学反应中的规律 作者:傅芳 来源:未知 日期:2016-04-24 22:12:00 点击:5888 所属专题:酸式盐
在高中化学教学中,常遇到酸式盐参加的化学反应,而教材中没有系统编排这部分内容,所以 学生在运用这部分知识时感到棘手。现根据多年的教学实践,将酸式盐的反应规律总结如下: 一、酸式盐与酸的反应 1. 酸式盐与无强氧化性酸的作用 参加反应的酸比形成酸式盐的酸酸性...
 [注解与辨疑3] 书写电离方程式常见错例分析 作者:汤芹 来源:未知 日期:2016-01-22 16:03:07 点击:616 所属专题:电离方程式
[注解与辨疑3] 书写电离方程式常见错例分析 作者:汤芹 来源:未知 日期:2016-01-22 16:03:07 点击:616 所属专题:电离方程式
...
 [注解与辨疑3] 书写电离方程式应注意的问题 作者:董啸 来源:未知 日期:2016-01-22 15:25:46 点击:1425 所属专题:电离方程式
[注解与辨疑3] 书写电离方程式应注意的问题 作者:董啸 来源:未知 日期:2016-01-22 15:25:46 点击:1425 所属专题:电离方程式
...
 [注解与辨疑3] 电离方程式的书写 作者:程新 来源:未知 日期:2016-01-22 14:41:08 点击:22689 所属专题:电离方程式
[注解与辨疑3] 电离方程式的书写 作者:程新 来源:未知 日期:2016-01-22 14:41:08 点击:22689 所属专题:电离方程式
一、知识梳理 1、概念:表示电离的式子叫电离方程式。 2、书写要点: (1) 强电解质:用“=== ” 如:HCl === H + +Cl - NaOH === Na + + OH— Na 2 SO 4 === 2Na + + S O 4 2 - (2) 弱电解质:用 ” 如:CH 3 COOH CH 3 COO - + H + NH 3 H 2 O NH 4 + + OH -...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。离子方程式书写的核心难点之一,在于 “特殊物质的拆分判断”—— 部分物质因结构、溶...
电离方程式是表征物质在水溶液或熔融态电离过程的化学用语,常规强电解质(如 NaCl、HS...
离子方程式书写四大原则之一关键是拆分问题 1、 溶解性规律 常规 K + 、 Na + 、 NH 4...
1.警惕“颜色陷阱”: ①若限定溶液无色,则Cu 2+ 、Fe 3+ 、Fe 2+ 、Cr 2 O 7 2 ...
用化学式 和 离子符号等来表示物质离解成自由移动离子过程的式子叫做电离方程式。 书...
一句话总结:熔融态就是 固体加热熔化后的状态 。 在某个层面上,它和液态是一回事 (...
AgOH 是经常被忽略其存在的一种化合物,那是因为AgOH的热稳定性极差,室温就能分解,...
金属导电是自由电子的定向移动。电解质溶液导电是阴阳离子的定向移动。电解质溶液是指...