
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑3] 电解质与非电解质注意事项 作者:化学自习室 来源:未知 日期:2022-01-02 14:19:33 点击:1267 所属专题:电解质
[注解与辨疑3] 电解质与非电解质注意事项 作者:化学自习室 来源:未知 日期:2022-01-02 14:19:33 点击:1267 所属专题:电解质
一、概念辨析 1、电解质与非电解质: 电解质:指在水溶液或熔融状态下可以导电的化合物,包括酸、碱、盐和水. 强电解质:在水溶液里全部电离成离子的电解质。 弱电解质:在水溶液里只有一部分分子电离成离子的电解质。 非电解质:指在水溶液和熔融状态下均不导电的化合物,主...
 [注解与辨疑3] 离子反应的问与答 作者:王笃年 来源:未知 日期:2021-11-08 09:33:33 点击:747 所属专题:离子反应
[注解与辨疑3] 离子反应的问与答 作者:王笃年 来源:未知 日期:2021-11-08 09:33:33 点击:747 所属专题:离子反应
1、为什么要学习离子反应? 构成化学物质的微粒有原子、分子、离子,物质的 性质就是这些粒子行为的集中表现,离中阶段,随着化学学习的深入,我们必须对离子(阳离子和阴离子) 这类构成物质的微观粒子的性质进行研究。 地球表面素有“三山六水一分田之说,且在“山” 和“田...
 [注解与辨疑3] 强、弱电解质概念辨析 作者:王笃年 来源:未知 日期:2021-10-29 16:02:02 点击:799 所属专题:弱电解质
[注解与辨疑3] 强、弱电解质概念辨析 作者:王笃年 来源:未知 日期:2021-10-29 16:02:02 点击:799 所属专题:弱电解质
问题1、同样的弱电解质分子,为什么有的电离有的不电离? “弱电解质只发生部分电离”的说法,只是从宏观上给出的判断.在水溶液中,电解质在H 2 O分子的作用下不断发生着电离、离子水合的过程。但是,弱电解质的阴离子结合H + 的能力很强,它们在溶液中遇到H 3 O + 时,有...
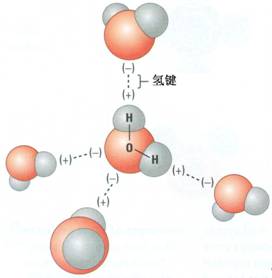 [注解与辨疑3] 高中化学离子共存知识点总结 作者:化学自习室 来源:未知 日期:2021-08-17 10:35:12 点击:2638 所属专题:离子共存
[注解与辨疑3] 高中化学离子共存知识点总结 作者:化学自习室 来源:未知 日期:2021-08-17 10:35:12 点击:2638 所属专题:离子共存
1、有气体产生。 H + 与C O 3 2 - 、HC O 3 - 、S O 3 2 - 、HS O 3 - 、S 2- 、HS - 等不能共存 如C O 3 2 - 、 S 2- 、HS - 、HS O 3 - 、等易挥发的弱酸的酸根与H + 不能大量共存, 主要是由于C O 3 2 - +2H + =CO 2 ↑+H 2 O、HS - +H + =H 2 S↑...
 [注解与辨疑3] 电离方程式的分类及书写 作者:化学自习室 来源:未知 日期:2021-04-07 10:56:24 点击:4961 所属专题:电离方程式
[注解与辨疑3] 电离方程式的分类及书写 作者:化学自习室 来源:未知 日期:2021-04-07 10:56:24 点击:4961 所属专题:电离方程式
电离理论是化学中的一个基本理论。在用它来定性地处理一些问题时,最为核心的知识内容就是,能区别出强弱电解质,能掌握不同类别电解质的特殊电离形式。因为电解质强弱关系到它的存在形态、及在离子方程式中的写法,而电离形式则关系到它的一些性质。 由于电解质强弱和它们...
 [注解与辨疑3] 离子共存问题总结 作者:化学自习室 来源:未知 日期:2020-12-09 11:42:02 点击:2012 所属专题:离子共存
[注解与辨疑3] 离子共存问题总结 作者:化学自习室 来源:未知 日期:2020-12-09 11:42:02 点击:2012 所属专题:离子共存
离子共存之一 (一)发生复分解反应,离子不能大量共存 1、有气体产生。 H + 与C O 3 2 - 、HCO 3 ˉ、S O 3 2 - 、HSO 3 ˉ、S 2- 、HSˉ等不能共存 如C O 3 2 - 、 S 2- 、HS - 、HS O 3 - 、等易挥发的弱酸的酸根与H + 不能大量共存, 主要是由于C O 3 2 - +2H...
 [注解与辨疑3] 溶解性表中AgOH一格中为什么是“—”? 作者:化学自习室 来源:RealChemistr微信公众号 日期:2022-08-03 09:57:35 点击:1933 所属专题:溶解性表
[注解与辨疑3] 溶解性表中AgOH一格中为什么是“—”? 作者:化学自习室 来源:RealChemistr微信公众号 日期:2022-08-03 09:57:35 点击:1933 所属专题:溶解性表
AgOH 是经常被忽略其存在的一种化合物,那是因为AgOH的热稳定性极差,室温就能分解,所以在复分解时得到AgOH后 就马上分解为氧化银和水,因而AgOH常温下不能稳定存在,与水的存在无必然联系。 那么为什么 AgOH 这种碱的稳定性这么差呢?那是由于银离子的极化作用和变形...
 [注解与辨疑3] 离子共存中的题设“陷阱”及误区警示 作者:化学自习室 来源:未知 日期:2020-06-13 11:09:10 点击:1121 所属专题:离子共存
[注解与辨疑3] 离子共存中的题设“陷阱”及误区警示 作者:化学自习室 来源:未知 日期:2020-06-13 11:09:10 点击:1121 所属专题:离子共存
条件类型 常见表述 误点点拨 常见的限制条件 “无色” Cu 2+ 、Fe 2+ 、Fe 3+ 、Mn O 4 - 等有色离子不能大量存在 “pH=1”或“pH=13” 溶液显酸性或碱性 “因发生氧化还原反应而不能共存” 只能是氧化性离子和还原性离子不共存,并不是其他离子反应,同时要注意...
 [注解与辨疑3] 高中化学中“少量、过量”离子方程式汇总 作者:化学自习室 来源:未知 日期:2020-04-03 13:34:47 点击:7685 所属专题:过量与少量 离子反应方程式
[注解与辨疑3] 高中化学中“少量、过量”离子方程式汇总 作者:化学自习室 来源:未知 日期:2020-04-03 13:34:47 点击:7685 所属专题:过量与少量 离子反应方程式
01【HCl】 1、向NaAlO 2 溶液中滴入盐酸溶液至过量 (1)Al O 2 - +H + +H 2 O=Al(OH) 3 ↓ (2)Al(OH) 3 +3H + =Al 3+ +3H 2 O 向盐酸溶液中滴入NaAlO 2 溶液至过量 (1)Al O 2 - +4H + =Al 3+ +2H 2 O (2)3Al O 2 - +Al 3+ +6H 2 O=4Al(OH) 3 ↓ 向NaAlO...
 [注解与辨疑3] 强酸的电离能力完全相同吗? 作者:化学自习室 来源:未知 日期:2020-02-16 13:41:32 点击:1236 所属专题:电解质电离
[注解与辨疑3] 强酸的电离能力完全相同吗? 作者:化学自习室 来源:未知 日期:2020-02-16 13:41:32 点击:1236 所属专题:电解质电离
HCl、HNO 3 、HClO 4 等是我们中学常见的强酸,在水中是完全电离的,这意味着它们的酸的强度是相同的。但是,如果我们学习过元素周期律之后就会知道,同周期元素从左到右,非金属性逐渐增强,最高价氧化物的水化物的酸性也逐渐增强,那么理论上来说,HClO 4 的酸性应当是比H...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。离子方程式书写的核心难点之一,在于 “特殊物质的拆分判断”—— 部分物质因结构、溶...
电离方程式是表征物质在水溶液或熔融态电离过程的化学用语,常规强电解质(如 NaCl、HS...
离子方程式书写四大原则之一关键是拆分问题 1、 溶解性规律 常规 K + 、 Na + 、 NH 4...
1.警惕“颜色陷阱”: ①若限定溶液无色,则Cu 2+ 、Fe 3+ 、Fe 2+ 、Cr 2 O 7 2 ...
用化学式 和 离子符号等来表示物质离解成自由移动离子过程的式子叫做电离方程式。 书...
一句话总结:熔融态就是 固体加热熔化后的状态 。 在某个层面上,它和液态是一回事 (...
AgOH 是经常被忽略其存在的一种化合物,那是因为AgOH的热稳定性极差,室温就能分解,...
金属导电是自由电子的定向移动。电解质溶液导电是阴阳离子的定向移动。电解质溶液是指...