
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑3] 酸式盐在化学反应中的规律 作者:傅芳 来源:未知 日期:2016-04-24 22:12:00 点击:5932 所属专题:酸式盐
[注解与辨疑3] 酸式盐在化学反应中的规律 作者:傅芳 来源:未知 日期:2016-04-24 22:12:00 点击:5932 所属专题:酸式盐
在高中化学教学中,常遇到酸式盐参加的化学反应,而教材中没有系统编排这部分内容,所以 学生在运用这部分知识时感到棘手。现根据多年的教学实践,将酸式盐的反应规律总结如下: 一、酸式盐与酸的反应 1. 酸式盐与无强氧化性酸的作用 参加反应的酸比形成酸式盐的酸酸性...
 [注解与辨疑3] 书写电离方程式常见错例分析 作者:汤芹 来源:未知 日期:2016-01-22 16:03:07 点击:621 所属专题:电离方程式
[注解与辨疑3] 书写电离方程式常见错例分析 作者:汤芹 来源:未知 日期:2016-01-22 16:03:07 点击:621 所属专题:电离方程式
...
 [注解与辨疑3] 书写电离方程式应注意的问题 作者:董啸 来源:未知 日期:2016-01-22 15:25:46 点击:1435 所属专题:电离方程式
[注解与辨疑3] 书写电离方程式应注意的问题 作者:董啸 来源:未知 日期:2016-01-22 15:25:46 点击:1435 所属专题:电离方程式
...
 [注解与辨疑3] 电离方程式的书写 作者:程新 来源:未知 日期:2016-01-22 14:41:08 点击:22800 所属专题:电离方程式
[注解与辨疑3] 电离方程式的书写 作者:程新 来源:未知 日期:2016-01-22 14:41:08 点击:22800 所属专题:电离方程式
一、知识梳理 1、概念:表示电离的式子叫电离方程式。 2、书写要点: (1) 强电解质:用“=== ” 如:HCl === H + +Cl - NaOH === Na + + OH— Na 2 SO 4 === 2Na + + S O 4 2 - (2) 弱电解质:用 ” 如:CH 3 COOH CH 3 COO - + H + NH 3 H 2 O NH 4 + + OH -...
 [注解与辨疑3] 化学反应中的八大沉淀 作者:彭琳 来源:未知 日期:2020-04-14 09:40:28 点击:26322 所属专题:溶解性 氢氧化物沉淀
[注解与辨疑3] 化学反应中的八大沉淀 作者:彭琳 来源:未知 日期:2020-04-14 09:40:28 点击:26322 所属专题:溶解性 氢氧化物沉淀
1.在化学变化中,一般来说有八大沉淀: AgCl(氯化银)、BaSO 4 (硫酸钡)、CaCO 3 (碳酸钙)、BaCO 3 (碳酸钡)、Ag 2 CO 3 (碳酸银)、Mg(OH) 2 (氢氧化镁)、Cu(OH) 2 (氢氧化铜)、Fe(OH) 3 (氢氧化铁) 其中,AgCl , BaSO 4 ,CaCO 3 , BaCO 3 , Ag 2 CO 3 (颜色说法不一...
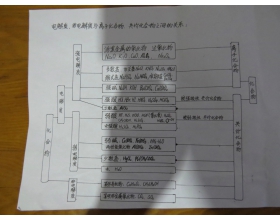 [注解与辨疑3] 离子化合物、共价化合物与电解质、非电解质之间的关系总结 作者:陈万 来源:未知 日期:2016-01-17 16:32:51 点击:7521 所属专题:离子化合物 共价化合物 电解质判断 非电解质
[注解与辨疑3] 离子化合物、共价化合物与电解质、非电解质之间的关系总结 作者:陈万 来源:未知 日期:2016-01-17 16:32:51 点击:7521 所属专题:离子化合物 共价化合物 电解质判断 非电解质
【补充】(1)少数气态氢化物也是非电解质。如氨气。(2)活泼金属氢化物才是电解质。如氢化钠。 大致规律: 离子化合物包括铵盐、强碱、活泼金属化合物,其他的不活泼的金属化合物和只由非金属组成的化合物都是共价化合物。 除了离子化合物都是共价化合物。 通常认为: 电负...
 [注解与辨疑3] 碳酸氢铵与氢氧化钠的反应情况分析 作者:吴键 来源:未知 日期:2015-01-28 19:26:11 点击:2471 所属专题:反应先后 碳酸氢铵
[注解与辨疑3] 碳酸氢铵与氢氧化钠的反应情况分析 作者:吴键 来源:未知 日期:2015-01-28 19:26:11 点击:2471 所属专题:反应先后 碳酸氢铵
...
 [注解与辨疑4] 向等物质的量浓度NaOH和Na2CO3混合液中加入稀盐酸情况分析 作者:陈女婷 来源:未知 日期:2015-01-26 10:05:04 点击:1159 所属专题:反应先后
[注解与辨疑4] 向等物质的量浓度NaOH和Na2CO3混合液中加入稀盐酸情况分析 作者:陈女婷 来源:未知 日期:2015-01-26 10:05:04 点击:1159 所属专题:反应先后
【问题】向等物质的量浓度的NaOH和Na 2 CO 3 的混合液中加入稀盐酸。下列离子方程式与事实不相符的是[ ] A、OH - +C O 3 2 - +2H + →HC O 3 - +H 2 O B、2OH - +C O 3 2 - +3H + →HC O 3 - +2H 2 O C、2OH - +C O 3 2 - +4H + →CO 2 ↑+2H 2 O D...
 [注解与辨疑3] 有关离子方程式和离子共存的易错判断 作者:胡中宇 来源:未知 日期:2018-08-08 17:17:15 点击:1387 所属专题:离子方程式正误判断 离子共存
[注解与辨疑3] 有关离子方程式和离子共存的易错判断 作者:胡中宇 来源:未知 日期:2018-08-08 17:17:15 点击:1387 所属专题:离子方程式正误判断 离子共存
( )1. 向Fe(NO 3 ) 2 溶液中滴加少量氢碘酸:3Fe 2+ +4H + +N O 3 - =3Fe 3+ +NO↑+2H 2 O ( )2. Fe 3 O 4 与稀硝酸反应的离子方程式为:Fe 3 O 4 +18H + =6Fe 3+ +H 2 ↑+8H 2 O ( )3. 在强碱性溶液中,次氯酸钠溶液与氢氧化铁反应制取高铁酸钠的...
 [注解与辨疑3] 离子反应的类型及发生条件 作者:赵亭 来源:未知 日期:2018-07-19 17:24:17 点击:3546 所属专题:离子反应条件
[注解与辨疑3] 离子反应的类型及发生条件 作者:赵亭 来源:未知 日期:2018-07-19 17:24:17 点击:3546 所属专题:离子反应条件
类型 实质 发生条件 实例 复分解 反应 酸碱盐、氧化物、水之间发生的非氧化还原反应 1 、生成难溶物(沉淀) 2 、生成难电离物(弱电解质) 3 、生成易挥发物(气体) Ba 2+ + SO 4 2- = BaSO 4 ↓ CH3COO - + H + =CH3COOH CO 3 2- +2 H + = CO 2 ↑ + H 2 O Ba 2+ + 2...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
通常不能,或者导电性极差。但存在重要的例外(主要是某些特...
预备知识 :要判断加入某物质后溶液溶液的导电性变化,核心是...
离子方程式书写的核心难点之一,在于 “特殊物质的拆分判断”...
电离方程式是表征物质在水溶液或熔融态电离过程的化学用语,...
离子方程式书写四大原则之一关键是拆分问题 1、 溶解性规律...
1.警惕“颜色陷阱”: ①若限定溶液无色,则Cu 2+ 、Fe 3+ 、...
用化学式 和 离子符号等来表示物质离解成自由移动离子过程的...
一句话总结:熔融态就是 固体加热熔化后的状态 。 在某个层面...