
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

【导读】乙醇、乙醛、乙酸可与水以任意比例互溶;二甲醚溶解度约1.5mol/L(RT),不能与水互溶,且随温度升高而降低。这些溶解度差异的核心原因是分子能否与水形成强有力的氢键。
如果乙醇、乙醛、乙酸像是很会社交的人,它们有办法(形成强氢键)与水分子“打成一片”。那么二甲醚则像是一个不太会主动社交的人,它只能被动地接受别人的邀请(作为氢键受体),自己却不主动(不能作为氢键供体),而且它还带了两个“不合群”的同伴(疏水-CH₃)。所以它只能有限的参与活动,多了就会自己聚在一起,无法完全融入
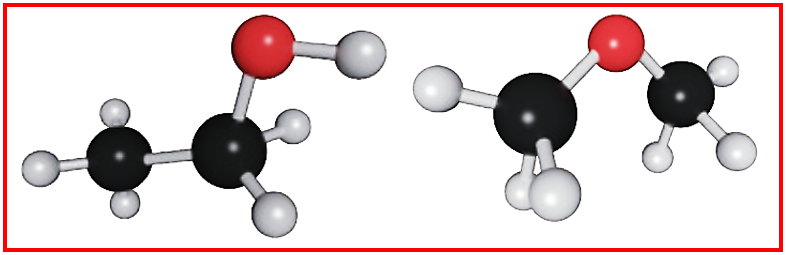
一、乙醇、乙醛、乙酸为什么能与水互溶?
都能与H₂O形成氢键“手拉手”而互溶。
三者均能与水互溶,核心原因是分子中含可与水分子形成氢键的极性基团,且分子极性相对较强,符合“相似相溶”原理。
C₂H₅OH含-OH,可与水分子的-OH形成强氢键,氢键作用远大于-C₂H₅的疏水作用。
CH₃CHO含-CHO,氧原子有孤对电子,可与水分子的H形成氢键,且分子极性强,能与水充分混合。
CH₃COOH含-COOH,羟基的H和羰基上的O均可与水分子形成氢键,氢键作用极强,且羧基极性远大于-CH₃的疏水作用。乙酸可以在水中电离出H⁺,与水发生强烈的酸碱相互作用,这进一步增强了其水溶性。
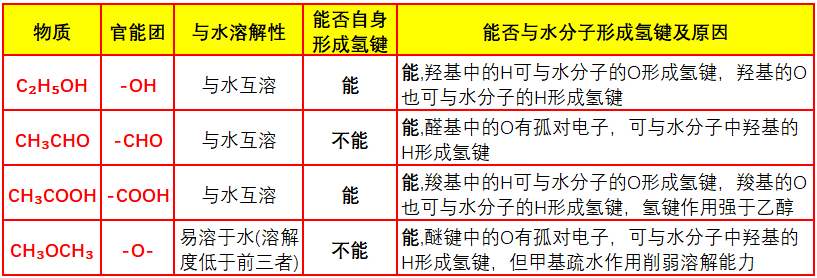
二、二甲醚CH₃OCH₃为什么不能与水互溶?
1.极性失配:甲醚分子极性不足,无法与水分子形成高效的极性相互作用。
由相似相溶原理可知互溶的前提是“溶质与溶剂的极性高度匹配”。
水分子O-H键的极性很强,偶极矩1.85D;水分子间通过强氢键可以形成稳定的“氢键网络”,溶解其他物质时,需要溶质分子的极性足以打破这一网络并嵌入其中。
二甲醚含极性C-O-C键,偶极矩约1.30D,整体极性远弱于水;其分子为对称的“醚键两端连甲基”结构CH₃-O-CH₃,非极性-CH₃“稀释”醚键的极性,分子整体极性仅为水的约70%,无法高效与水分子形成极性吸引,难以稳定嵌入水的氢键网络。
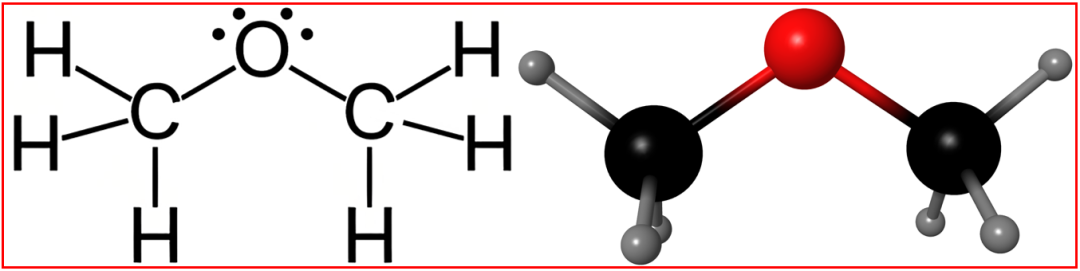
2.氢键作用“低效且单向”:无法形成稳定的双向氢键
二甲醚能溶于水,但不互溶,依赖于其与水分子的弱氢键作用,但这种作用存在本质缺陷。
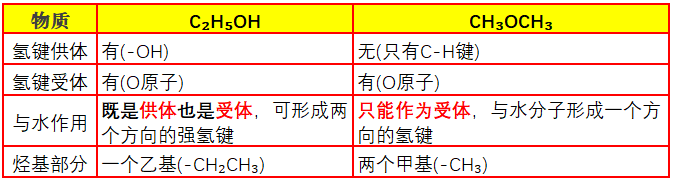
氢键的形成需要“氢键供体”(O-H、N-H等极性键能提供带部分正电的H)和“氢键受体”(O、N等电负性原子接受H);
水分子O-H键的H是氢键供体,O原子有孤对电子也是氢键受体,可形成水分子间的双向氢键网络。
二甲醚的醚键O原子有孤对电子能作为氢键受体(与水分子H形成O-H…O氢键),但分子中无O-H键无法作为氢键供体,不能提供带部分正电的H与水分子的O形成氢键;
“水分子→二甲醚”提供氢键的这种“单向氢键”的作用强度远低于水分子间氢键,且无法形成“二甲醚-水分子”的双向稳定氢键网络,导致二甲醚分子难以被水“稳定包裹”,只能部分溶解而非无限互溶。
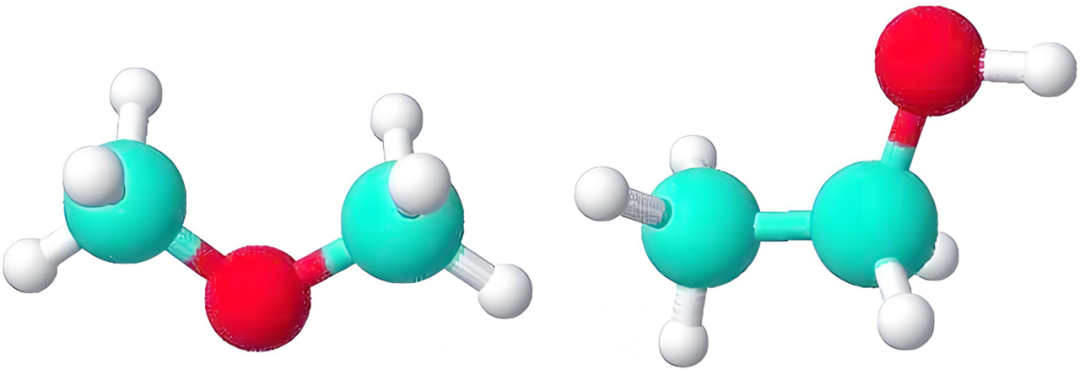
3.非极性甲基的“疏水排斥”:限制溶解上限
二甲醚中两个-CH₃是典型的疏水基团,会产生“疏水效应”。
当二甲醚分子进入水的氢键网络时,非极性的-CH₃迫使周围水分子形成“有序的溶剂化层”,水分子围绕-CH₃排列,以减少与疏水基团的接触,这一过程导致体系△S熵减,热力学不利;
少量二甲醚溶解时,疏水效应的影响可被“二甲醚与水分子的氢键作用”抵消;但当二甲醚浓度升高到一定程度的上限时,大量-CH₃的疏水排斥会叠加,水分子无法再为更多二甲醚分子提供稳定的溶剂化环境,多余的二甲醚分子会因“疏水聚集”而与水分层,无法继续溶解,最终无法互溶。


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
要理解溴的四氯化碳溶液不能与饱和醛发生反应,核心在于反应...
酸酐(Acid Anhydride)是一类在无机化学与有机化学中均具有重要...
一、电子效应:官能团的“性格”密码 在比较酸性前,必须先理...
有机氰化物是指分子中含有氰基(-CN,氰基中 C 与 N 以三键连接...
有机化学中的还原反应是高考核心考点之一,其本质是有机分子...
【导读】环氧乙烷与HO的反应是亲核加成反应,其本质是环氧乙...