
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
与同族元素氢化物相比,H2O和HF的熔沸点特别高,这是由于这些分子间存在着氢键的缘故。冰中O—H…O氢键的作用能为18.8 kJ•mol-1,而(HF)n中F—H…F氢键的作用能为28.1 kJ•mol-1。就氢键强度而言,F—H…F大于O—H…O,那么又该如何解释H2O的熔点、沸点(分别为0℃和100℃)比HF(分别为-83.1℃和19.5℃)高的事实呢?
(1)两者形成的氢键数目不同。
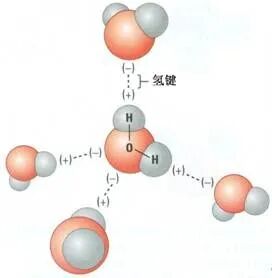
在液态HF中,一个HF分子只能用头尾与另外两个HF分子形成两个氢键,折合每摩尔HF分子只分享到一摩尔氢键;而在H2O中,每个H2O分子中有可能形成四个氢键,每个氢原子分享到一个氢键,折合每摩尔H2O中有两摩尔氢键。因此每摩尔H2O形成氢键的总数比每摩尔液态HF来得多。
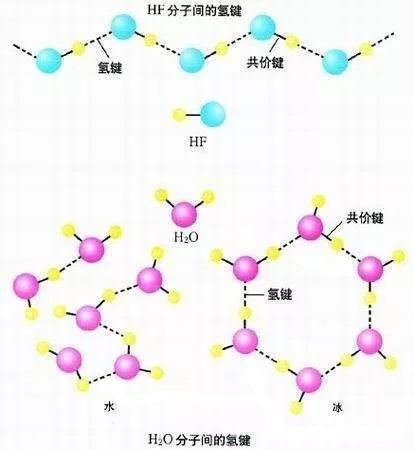
(2)熔化或沸腾时两者破坏氢键的程度不同。
物质的熔化或沸腾并不意味着它一定要变成单个分子。液态HF沸腾并不需要破坏所有的氢键,而只需破坏其中的一部分。
红外及电子衍射等研究表明,气态HF是单体和环状六聚体(HF)6的一种平衡混合物,在一定的温度和压力下链状二聚体(HF)2也可能存在。与此不同,在固态水(冰)中,水分子大范围地以氢键互相联结成晶体,在液态水中多个水分子通过氢键结合在一起形成(H2O)n ,而在水蒸气中并不存在缔合分子,它是由单个H2O分子所组成,所以水沸腾要破坏全部的氢键。也就是说,就单个氢键而言,键能F—H…F大于O—H…O,但就固态变成液态或液态变成气态所需消耗的能量来说,H2O却大于HF,这就是H2O的熔沸点比HF高的主要原因。
有关数据表明,冰中氢键的作用能为18.8 kJ•mol-1,而冰的熔化热只有5.0 kJ•mol-1。即使冰的熔化热全部用于破坏冰的氢键而无他用,在0℃时冰熔化成液态水,至多只能打破冰中全部氢键的约13%[等于5/(18.8×2)]。这就意味着,刚刚熔化的水中仍存在着许多由氢键作用而形成的小集团(H2O)n。随着温度升高,水中的氢键逐渐断裂。但在沸点时液态水中依然存在相当数量的氢键,这可由373K时水的蒸发热为40.63 kJ•mol-1得以证实。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...