
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、沸点、熔点与溶解度
沸点与熔点:分子间氢键的存在,意味着在物质发生相变(如从液态到气态)时,除了需要克服范德华力,还必须提供额外的能量来破坏这些氢键网络。
因此,能够形成氢键的分子(如水、乙醇、氨)通常比分子量相近但不能形成氢键的分子(如甲烷、乙烷)具有异常高的熔点和沸点。分子内氢键因不参与分子间相互作用,可能降低熔点。
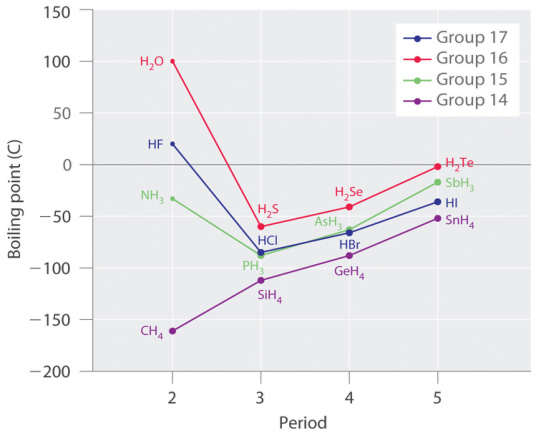
图1氢键对不同周期共价氢化物沸点的影响
溶解度:俗称的“相似相溶”原理在很大程度上是由氢键主导的。一个物质能否溶于某种溶剂,取决于溶质-溶剂间的相互作用能否补偿破坏溶质-溶质和溶剂-溶剂间相互作用所需的能量。
当溶质分子能够与溶剂分子形成氢键时,其溶解度通常会显著增加。例如,低级醇和糖类因含有大量羟基能与水形成氢键,故在水中具有良好的水溶性。反之,氢键能力也影响着脂溶性,是药物分子设计中评估其穿膜能力的重要参数。
二、酸碱性(pKa)
氢键对分子酸碱性的影响是通过稳定或去稳定分子及其共轭酸/碱来实现的。
增强酸性:当一个酸(HA)失去质子(H⁺)形成其共轭碱(A⁻)时,如果A⁻能够通过分子内或与溶剂分子形成氢键而得到额外的稳定性,那么这个去质子化的过程就更容易发生,从而使得母体酸HA的酸性增强(即pKa值降低)。
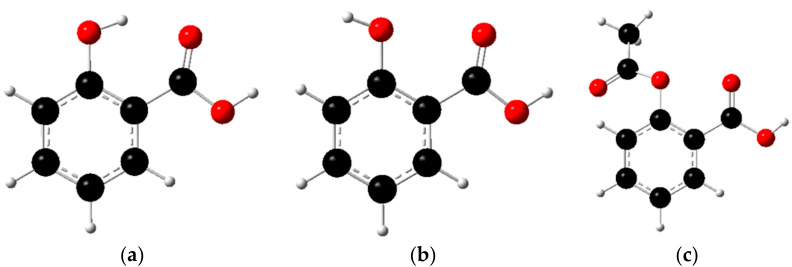
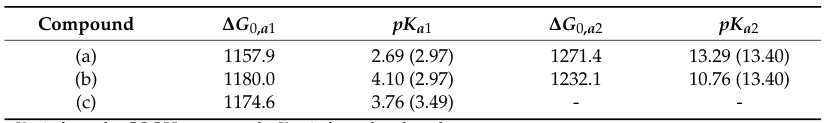
图2 (a、b)水杨酸的两种构象,其中a的苯酚OH和COOH形成分子内氢键,b不形成氢键(c)阿司匹林(乙酰水杨酸)不形成氢键
调控质子转移:在酸碱反应和催化过程中,氢键网络扮演着“质子导线”的角色,促进质子的快速转移。氢键的形成、断裂和重排是许多酶催化反应中质子转移步骤的核心机制。
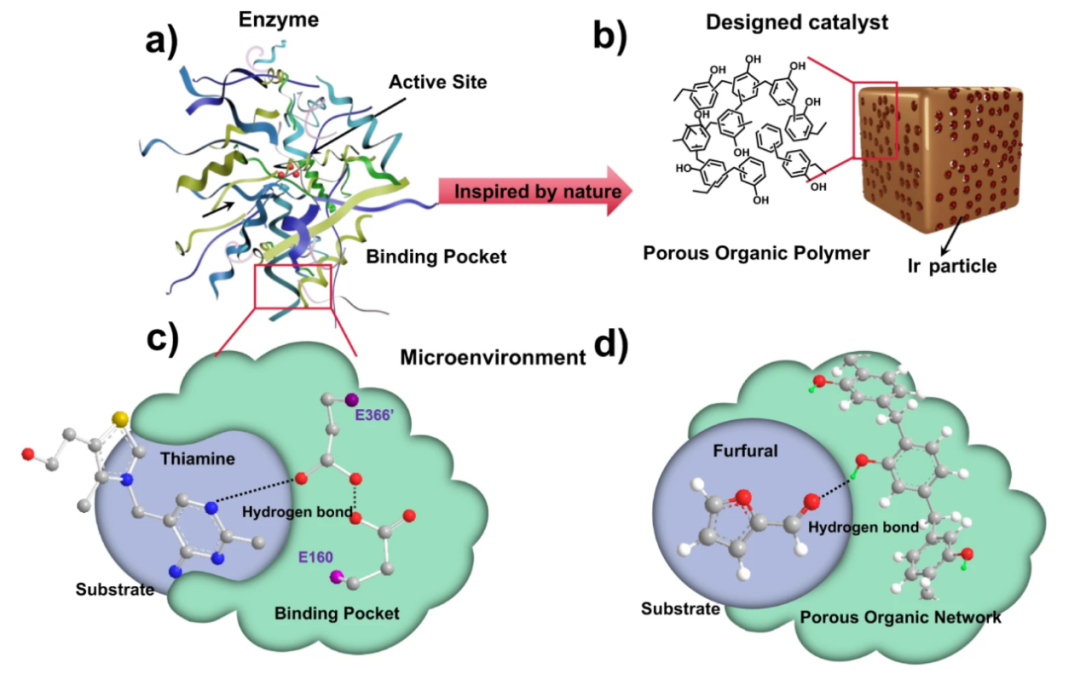
图3 氢键网络的作用示意图。
三、化学反应性
影响反应速率:通过与反应物、中间体或过渡态形成氢键,可以改变它们的能量。如果氢键能够选择性地稳定过渡态,它将有效降低反应的活化能,从而加速反应,这是一种重要的催化模式,被称为氢键催化。
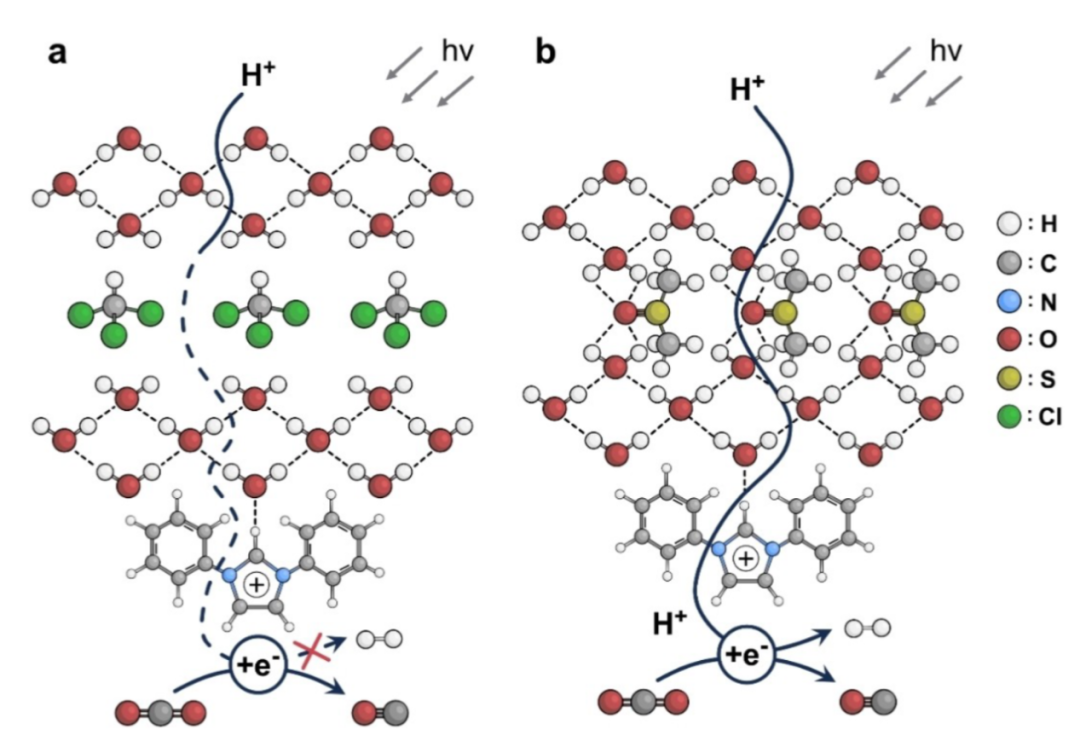
图14 在光催化CO2RR过程中,氢键网络对H2生成的影响。
控制反应选择性:氢键的方向性可以用来“固定”反应物的构象或引导试剂从特定的方向进攻,从而实现对反应区域选择性或立体选择性的控制。在不对称催化中,手性催化剂通过与底物形成特定的氢键网络,能够高效地诱导产物单一手性构型的生成。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...