
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【导读】分子间氢键越强,破坏氢键需要能量越多,物质的沸点越高。常压下水的沸点为100℃,乙醇的沸点为78℃。尽管乙醇分子量更大,但因氢键较弱,克服分子间力所需能量更低。水分子间的氢键更强,需要更高温度才能破坏分子间的作用力。
水分子的氢键强于乙醇的关键因素如下:
①水分子无烷基推电子效应,O-H键极性更强;
②水分子无空间位阻的氧孤对电子,受体能力更强;
③水分子间能形成高效的氢键网络结构。
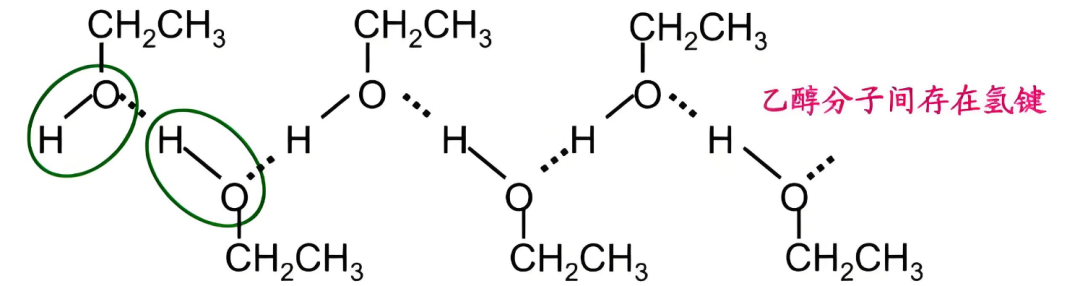
一、氢键强度的决定因素有哪些?
①供体(O-H)的酸性:O-H键极性越强,H⁺正电性越明显,氢键越强。
②受体(O)的碱性:受体原子电子云密度越高,吸引H⁺能力越强。
③空间位阻:大基团会阻碍氢键形成。
④分子对称性与氢键网络:分子能否形成多方向氢键网络。
二、水与乙醇的分子结构对比分析
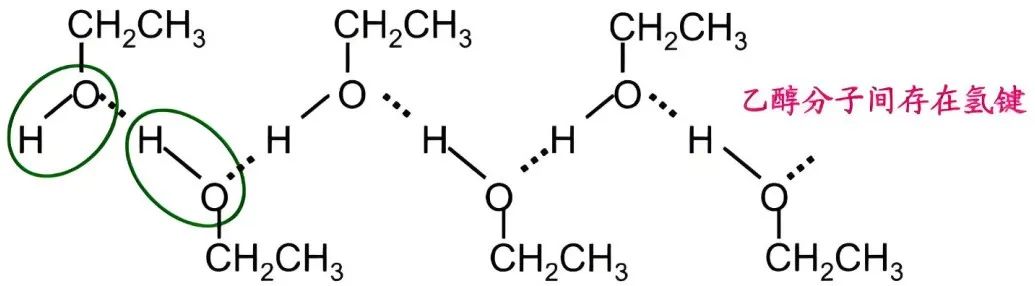
三、液体水分子整体氢键更强的关键因素有哪些?
水分子中O-H键极性更强。水分子中O-H键的O原子直接连接两个H,氧原子吸电子效应更集中,导致O-H偶极矩1.85D,键的极性极强。乙醇的O-H键连接乙基(推电子基团),乙基的推电子效应削弱了O-H极性,偶极矩只有1.69D。
水分子中受体氧原子暴露更充分。水分子呈四面体构型,氧原子的两对孤对电子完全暴露,易于接受质子。乙醇的氧原子被乙基部分包围,形成空间位阻,阻碍其他分子接近孤对电子。
水分子间的氢键网络更高效。水分子可通过四面体网络最多形成4个氢键(2个供体+2个受体),可以构成稳定的三维网络。乙醇理论上能形成1个O-H供体氢键+2个受体氢键(通过氧孤对电子),实际一般1-2个氢键,且乙基破坏网络连续性。

四、甲醇的沸点为什么比乙醇低?
CH₃OH相对分子质量32,沸点65℃;CH₃CH₂OH相对分子质量46,沸点78℃。
CH₃OH因甲基位阻小于乙基,其氢键强度大于乙醇氢键,但沸点却相反,低于乙醇,这说明二者沸点差异主要是由因分子量增加主导,而非氢键增强主导。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
要理解溴的四氯化碳溶液不能与饱和醛发生反应,核心在于反应...
酸酐(Acid Anhydride)是一类在无机化学与有机化学中均具有重要...
一、电子效应:官能团的“性格”密码 在比较酸性前,必须先理...
有机氰化物是指分子中含有氰基(-CN,氰基中 C 与 N 以三键连接...
有机化学中的还原反应是高考核心考点之一,其本质是有机分子...
【导读】环氧乙烷与HO的反应是亲核加成反应,其本质是环氧乙...