
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、依据溶液的颜色
如果试题已指明溶液无色,则有色离子不能大量共存。常见呈现颜色的离子有:外壳电子数为9~17的第一过渡系元素的水合离子,能吸收一定波长的可见光,使其离子由基态跃迁到激发态,而呈现颜色。这些离子的颜色列
于表1。

水溶液中某些含氧酸根是有色的。例如,MnO4-呈紫色,MnO42-呈绿色,CrO42-呈黄色,Cr2O72-显橙红色,VO3-显黄色。
2电子或8电子外壳的离子是无色的。例如,Li+,Na+,K+,Ca2+,Sr2+,Ba2+,F-,Cl-,Br-,I-,S2-,Se2-等。
二、依据溶液的酸碱性
1.由试题所给条件确定溶液的酸碱性
如果试题给出溶液的pH<7,则为酸性;pH>7,则为碱性。如果试题指明,在298 K,水的电离度减小,则溶液可能是酸性,也可能是碱性。其原因是:在298 K,纯水电离所产生的H+和OH-浓度的乘积是1×10-14,即水的离子积,[H+]×[OH-]=1×10-14。在纯水中加入较大量的可溶性强酸时,可将酸电离所产生的H+的浓度,当做溶液中H+的总浓度,且[H+] 1×10-7mol·L-1。这时水的离子积仍保持为1×10-14,故由水电离所产生的[OH-]和[H+]均小于1×10-7mol·L-1。由此可见,加入可溶性酸时,能抑制水的电离,使其电离度减小,溶液呈现酸性。同理,加入较大量的可溶性强碱时,水的电离度也能显著减小,溶液呈现碱性。
2.在酸性或碱性溶液中不能大量共存的离子
在强酸性溶液中,由两性氢氧化物生成的含氧酸根不能大量共存,例如,AlO2-,ZnO22-,CrO2-等。在强碱性溶液中,由两性氢氧化物电离所产生的简单阳离子不能大量共存,例如,Al3+,Cr3+,Zn2+等。
三、依据非氧化还原反应
水溶液中离子之间能够发生非氧化还原反应时,则不能大量共存。离子之间的非氧化还原反应可区分为:
1.生成难溶于水的物质
(1)Pb2+,Ag+,Hg2 2+与Cl-不能大量共存,因为能生成难溶的PbCl2,AgCl,Hg2Cl2。
(2)Cu2+,Cd2+,Bi3+,Hg2+,As3+,Sb3+,Sn2+和Ag+与S2-,HS-不能大量共存,因为能生成难溶于水和稀酸的硫化物。
(3)Mn2+,Fe2+,Co2+,Ni2+和Zn2+与S2-不能大量共存。虽然它们的硫化物能溶于稀酸([H+]为0.3 mol·L-1),但是它们能同(NH4)2S和NH3·H2O溶液中的S2-反应,生成难溶的硫化物沉淀。
(4)Ca2+,Sr2+,Ba2+,Fe2+,Pb2+,Zn2+和Ag+与CO32-不能大量共存,因为能生成难溶的碳酸盐。
(5)Ca2+,Sr2+和Ba2+与SO42-不能大量共存,因为CaSO4微溶于水,SrSO4和BaSO4难溶于水。
(6)Ca2+,Sr2+和Ba2+与PO43-不能大量共存,因为它们的磷酸盐难溶于水。
(7)Mg2+,Cu2+,Zn2+,Al3+和Fe3+与OH-不能大量共存,因为它们的氢氧化物难溶于水。
(8)Al3+和S2-,不能大量共存于溶液中,因为二者能完全水解,生成难溶的Al(OH)3和H2S。
2.生成难电离的物质
(1)H+与OH-不能大量共存,因为能反应生成难电离的H2O。H2PO4-,HCO3-与OH-不能大量共存,因为二者同OH-反应分别生成PO43-,CO32-和难电离的H2O。
(2)ClO-与H+不能大量共存,因为能生成难电离的HClO。
3.生成气态物质
(1)CO32-,HCO3-,SO32-和S2-与H+不能大量共存,因为它们能同H+反应,分别生成CO2,SO2,H2O和H2S。Al3+与CO32-不能大量共存,因为二者水解,相互反应生成难溶的Al(OH)3和气体CO2。
(2)NH4+与OH-不能大量共存,因为二者反应,能生成气体NH3和H2O。
4.生成配合物
当两种离子在水溶液中反应生成配合物时,则二者不能大量共存。例如,Fe3+与SCN-不能大量共存,因为二者反应,生成配合物[Fe(NCs)n]3-n(n=1~6)。Ag+与CN-不能大量共存,因为二者反应,生成[Ag(CN)2]-。
四、依据氧化还原反应
在水溶液中,如果氧化性离子与还原性离子能自发地进行氧化还原反应,则二者不能大量共存。
1.根据化合价判断离子的氧化性或还原性
在离子中某元素的原子呈现最高化合价时,这个离子只有氧化性,例如,SO42-;呈现中间价态时,既有氧化性,又有还原性,例如,SO32-;呈现最低化合价时,只有还原性,例如,S2-。由于氮的最高化合价是+5,最低化合价是-3,所以,NO3-只有氧化性,NO2-既有氧化性,又有还原性,NH4+只有还原性。MnO4-和Cr2O72-只有氧化性,二者是强的氧化剂,因为锰的最高化合价是+7,铬的最高化合价是+6。
2.自发进行氧化还原反应的条件
自发地进行氧化还原反应的条件是强的氧化剂和强的还原剂反应,生成弱的还原剂和弱的氧化剂。
例如:MnO4-强氧化剂+5Fe2+强还原剂+8H+=Mn2+弱还原剂+5 Fe3+弱氧化剂+4H2O
3.氧化剂和还原剂相对强弱的比较
(1)酸性介质中氧化剂和还原剂的相对强弱
在酸性介质中,温度是298 K,离子浓度为1 mol·L-1,气体分压为1.01×105Pa,某些常见氧化剂的氧化性和还原剂的还原性的相对强弱列于表2。
表2 酸性介质中常见氧化剂的氧化性和还原剂的还原性的相对强弱

在表2中,由上到下,氧化剂的氧化性依次增强。由上到下,氧化剂的氧化性依次增强,最强的氧化剂是MnO4-;最弱的氧化剂是SO42-。由下到上,还原剂的还原性依次增强,最强的还原剂是SO32-;最弱的还原剂是MnO2。
在某较强氧化剂和较强还原剂之间,该氧化剂的还原产物和还原剂的氧化产物之间,画两条对角线。位于对角线左下角的氧化剂和位于右上角的还原剂是反应物;另一对角线位置的是生成物。
例如,由Cr2O72-与Fe2+,Cr3+与Fe3+的对角线可知,下面氧化还原反应可自发进行:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
显而易见,位于表2中左下方的离子和右上方的离子在酸性溶液中不能大量共存。
综上所述,可得出以下结论:
①在酸性介质中MnO4-与简单阴离子Cl-,Br-,I-,Fe2+,低价含氧酸根SO32-和NO2-不能大量共存于溶液中。
②在酸性介质中Cr2O72-与简单阴离子Br-,I-,Fe2+,低价含氧酸根SO32-,NO2-不能大量共存于溶液中。
③在酸性介质中,Cl-与ClO-,Cl-与ClO3-,Br-与BrO-,Br-与BrO3-,I-与IO-,I-与IO3-不能大量共存,因这它们之间能够进行高低价反应分别生成卤素单质Cl2,Br2,I2。
(2)碱性介质中,某些氧化剂和还原剂的相对强弱。
在298 K,离子浓度为1 mol·L-1时,碱性介质中某些氧化剂和还原剂的相对强弱列于表3。
表3 碱性介质中某些氧化剂和还原剂的相对强弱
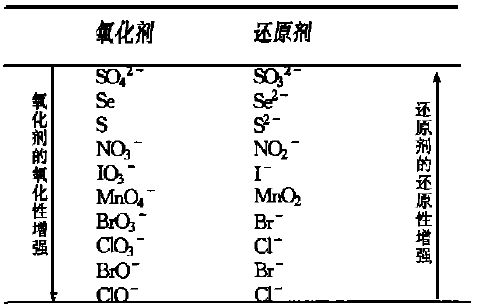
由表3可得出结论:
①在碱性介质中,MnO4-与I-,Se2-,S2-,SO32-,NO2-不能大量共存于溶液中。
②在碱性介质中,BrO3-与I-,ClO3-与Br-,BrO-与Cl-,ClO-与Br-不能大量共存于溶液中。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
1、酸性不同的酸遇同一种碱 当同一溶液中存在多种酸时,若向...
一、FeBr 2 、FeI 2 溶液与氯气反应的问题 例1、FeBr 2 溶液与氯气反...
在溶液中离子是否大量共存的问题是一种常考的选择题型,由于...
离子方程式的正确书写是高中化学教学中的重点内容之一。有很...
关于一种物质与多种物质发生化学反应时,一定要确定反应的先...