离子方程式的判断和书写一直是高考的热点和必考点,也是高考的难点,但考生在解决这类问题时,错误率高。同学们在平时的学习中习惯先书写化学方程式,然后再改写成离子方程式,这样既费时,效果又不好。现根据自己的心得和教学实际,总结出四步法书写离子方程式,供大家参考。
第一步 明反应
要求学生在书写离子方程式之前,先明白反应物之间能否发生反应。如果能,要明白是哪些离子参加了反应,生成物是什么或有哪些生成物。还要明白是否为氧化还原反应,以及氧化还原的顺序和程度,有无量的问题等等,力争在书写前做到心中有数。
例如,下列方程式的书写:
1、在FeCl2溶液中通入H2S气体:Fe2++H2S=FeS↓+2H+
[错,FeS易与酸反应,该反应不能发生]
2、BaCl2、CaCl2溶液中通入SO2或CO2:Ca2++CO2+H2O=CaCO3↓+2H2+
[错,CaCO3和BaCO3等均易与酸反应,该反应不能发生]
3、Fe与稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑
[错,铁与酸常温下反应置换氢气,只能生成二价铁]
4、在Ca(ClO)2溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
[错,HClO会将CaSO3氧化成CaSO4]
5、BaCO3粉末中加入稀H2SO4:BaCO3+2H+=Ba2++H2O+CO2↑
[错,Ba2+ 会与SO42-生成BaSO4]
6、在NaHSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓
[错,H+和OH-要反应生成水]
7、在NH4HCO3溶液中加入过量的NaOH:HCO3-+OH-=H2O+CO32-
[错,过量的OH-会与NH4+反应生成NH3.H2O]
8、CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-=BaSO4↓
[错,Cu2+和OH-会生成Cu(OH)2沉淀]
9、在C6H5ONa溶液中通入CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
[错,因为H2CO3﹥C6H5OH﹥HCO3-(酸性),应该生成HCO3-]
第二步 熟性质
要求学生熟悉物质在离子方程式中应该写离子还是化学式。一般而言,不能写成离子的物质有:气体、单质、氧化物、多元弱酸及多元弱酸的酸式根、难溶物、难电离的物质等。能写成离子的物质有:易溶于水的强电解质。如果微溶物做反应物且在澄清的溶液中时,应拆写成离子,如果做生成物或在浊液中时,应写化学式。
例如,下列方程式的书写:
1、Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
[错,HClO为弱酸,应写化学式]
2、FeS和稀H2SO4反应:S2-+2H+=H2S↑
[错,FeS为难溶物,应写化学式]
3、澄清石灰水中加入稀硝酸:Ca(OH)2+2H+=Ca2++2H2O
[错,澄清石灰水中的Ca(OH)2应该拆写成离子]
4、用石灰乳吸收少量的SO2:2OH-+SO2=SO32-+H2O
[错,石灰乳为的Ca(OH)2浊液,应写化学式]
从上述例子可以看出:无论是反应物还是生成物,能否拆写成离子,是由这个物质在溶液中存在的主要形式决定的。
5、CaCl2溶液和Na2SO4溶液混合:Ca2++SO42-=CaSO4↓(对)
6、盐酸和氨水混合:H++OH-=H2O
[错,氨水中的NH3.H2O为弱电解质,不应拆写成离子]
7、将H2S气体通入(CH3COO)2Pb溶液中:Pb2++H2S=PbS↓+2H+
[错,醋酸为弱电解质,应写化学式]
第三步 清条件
要求学生弄清楚反应条件和符号的正确书写。每年高考试题中都对有关量的离子方程式的书写进行了考查。一般来说,量的离子方程式分为定性类和定量类两种情况。同时要注意有关符号的书写(如:↓、↑、→、=、 等)。
一、定性类量的问题:
用少量、适量、过量或逐滴加入等条件来限定某一反应物的量,一般是以量少的作为标准来书写。如果量少的是多离子参加反应,则这些离子间的比例一定要与反应物中量的比例一致。
例如,下列离子方程式的书写:
1、用氨水吸收少量的SO2:NH3.H2O+SO2=HSO3-+NH4+
[错,应为SO2少,故应生成SO32-]
2、在(NH4)2SO4溶液中加入少量的Ba(OH)2:
NH4++SO42-+Ba2++OH-=BaSO4↓+NH3.H2O
[错,因为Ba(OH)2少量,所以Ba2+与OH-一定要满足1:2的比例]
3、在FeI2溶液中加入少量的溴水:2Fe2++2I-+2Br2=2Fe3++I2+4Br-
[错,因为Br2的量少,故不Fe2+能被氧化]
4、向次氯酸钙溶液中通入过量的二氧化碳:
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
[错,因为CO2过量,应该生成Ca(HCO3)2]
5、向稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe3++NO↑+4H2O
[错,因为是过量的铁粉,应该生成Fe2+]
6、向溴化亚铁溶液中通入过量的氯气:2Fe2++2Br-+2Cl-=2Fe3++Br2+4Cl-
[错,因为氯气过量,Fe2+和Br-会被完全氧化,二者比例应该为1:2]
7、将NaOH溶液逐滴加入AlCl3溶液中,直至过量:
Al3++3OH-=Al(OH)3↓
[错,因为NaOH是过量的,故应生成AlO2-]
二、定量类量的问题:
在题目中给出了明确的量的关系,一般情况是考查反应中点的问题,其等于恰好完全反应。
例如,下列离子方程式的书写:
1、常温下,在NaHSO4溶液中逐滴加入Ba(OH)2溶液,使溶液中的PH值恰好等于7:2H++SO42-+Ba2++2OH-=BaSO4+2H2O
[对,要使溶液的PH=7,即让H+和OH-恰好完全反应这个点,但此时的SO42-就没有被Ba2+反应完全]
2、在FeBr2溶液中通入一定量的Cl2,使被氧化的Br-与未被氧化的Br-相等:2Fe2++4Br-+3Cl2=2Br2+6Cl-+2Fe3+
[错,因为Br-只有一半被氧化,所以Fe2+与Br-的物质的量之比为1:1]
3、在Ba(OH)2溶液中逐滴加入NH4HSO4至沉淀刚好不再产生为止:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3.H2O+H2O
[对,让Ba2+与SO42-满足了1:1,然后在考虑其他离子间反应的情况]
三、反应符号的正确书写:
“↓、↑、→、=、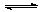 ”这五种符号,其正确使用的范围是:“=”只出现在无机反应中,“→”只出现在有机反应中,而“
”这五种符号,其正确使用的范围是:“=”只出现在无机反应中,“→”只出现在有机反应中,而“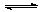 ”只出现在可逆反应、弱电解质的电离或盐类水解等反应中。“↑”是用在反应物中没有气体,而生成物中有气体的情况,“↓”是用在反应物中没有固态物质而生成物中出现了固态物质。
”只出现在可逆反应、弱电解质的电离或盐类水解等反应中。“↑”是用在反应物中没有气体,而生成物中有气体的情况,“↓”是用在反应物中没有固态物质而生成物中出现了固态物质。
例如,下列离子方程式的书写:
1、AlCl3溶液和NaAlO2溶液反应:Al3++3AlO2-+6H2O=4Al(OH)3↓
[对,因为是双水解,能进行彻底]
2、制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3(胶体)+3H+
[对,胶体不是沉淀,不用“↓”,胶体是稳定的,反应不可逆]
3、Na2S水解:S2-+H2O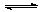 HS-+OH- HS-+H2O
HS-+OH- HS-+H2O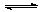 H2S+OH-
H2S+OH-
[对,单水解很弱,属于可逆反应。多元弱酸根水解分步进行]
4、小苏打溶液和甲酸溶液混合:HCO3-+HCOOH→ HCOO-+CO2↑+H2O
[对,有机反应中用→,反应后生成了气体,所以用↑]
5、向C6H5ONa溶液中通入足量的CO2:
C6H5O-+H2O+CO2→C6H5OH↓+HCO3-
[对,因为C6H5OH在700C以下时,水溶性较差,故用↓。]
第四步 查守恒
离子方程式是属于化学方程式的一种,它也必须满足质量守恒、电荷守恒和得失电子守恒的基本规律。故在书写完离子方程式以后,检查离子方程式是否守恒是非常必要的。
例如,下列离子方程式的书写:
1、Cu+NO3-+4H+=Cu2++NO↑+2H2O
[错,电荷不守恒,得失电子不守恒]
2、铝粉溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑
[错,电荷不守恒,得失电子不守恒]
3、氯气通入热的氢氧化钠溶液中:Cl2+4OH-=Cl-+ClO3-+2H2O
[错,电荷不守恒,得失电子不守恒]
其实在高考的选择题中,我们经常遇到的题型是判断离子方程式书写是否正确,解决这种类型题一般采用排除法。就是说先进行第四步,然后进行第一、二、三步,当然第三步中的有关量的离子方程式的书写一直是高考考试的重点和难点。
作者简介
田贵荣,男,中学化学一级教师。1998年从西南师范大学毕业,在四川省宜宾市第一中学任教至今,先后担任了3个高三毕业班的化学教学和班主任工作。教学成绩一直列全市前茅,有20多篇文章在市级及市级以上报刊发表或交流,其中国家级2篇,省级2篇,市级19篇,多次承担市级统考的命题和审题工作。现担任高2007级化学教学工作,宜宾市一中教科处主任.
联系地址:四川省宜宾市第一中学校教科处
邮编: 644000
联系电话:0831-8358139(办),0831-8011639(手)



 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。