
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在化学热力学与工业生产的交叉领域,范特霍夫方程将平衡常数与温度的抽象关系转化为可量化、可应用的实用工具。它不仅是理解化学平衡移动规律的核心理论,更是工业生产中优化工艺参数的科学依据,同时也是高考化学考查学生综合应用能力的高频考点。
范特霍夫方程是荷兰化学家雅各布斯·范特霍夫提出的描述平衡常数K与热力学温度T量关系的核心方程,其建立了宏观工艺条件与微观平衡状态的内在联系,为后续应用奠定了理论基础。
(一)表达式与符号定义
范特霍夫方程有两种常用表达形式,分别适用于不同场景:
1. 对数形式(图像分析核心):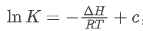
该形式与一次函数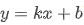 度契合,其中纵坐标
度契合,其中纵坐标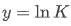 (平衡常数的自然对数),横坐标
(平衡常数的自然对数),横坐标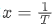 热力学温度的倒数),斜率
热力学温度的倒数),斜率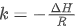 截距
截距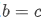 与反应本身性质相关的定值);
与反应本身性质相关的定值);
2. 定积分形式(平衡常数换算):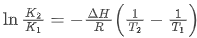 适用于已知两个温度下的平衡常数,计算反应焓变或某一温度下的平衡常数。
适用于已知两个温度下的平衡常数,计算反应焓变或某一温度下的平衡常数。
方程中各符号的物理意义明确:ΔH反应的标准焓变(吸热为正、放热为负),R理想气体常数(固定正值,约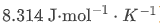 ,T热力学温度(单位K与摄氏温度换算关系为
,T热力学温度(单位K与摄氏温度换算关系为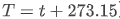 。
。
(二)核心逻辑与平衡规律
从方程推导的关键结论,是理解平衡移动的核心:由于R固定正值,斜率K符号由ΔH定,进而直接反映温度对平衡的影响:
• 当ΔH>0吸热反应)时,斜率K<0温度升高(1/T小)会使lnK增大,K上升,平衡正向移动;
• 当ΔH<0(放热反应)时,斜率K>0温度升高(1/T减小)会使lnK小,K下降,平衡逆向移动。
同时,斜率绝对值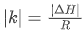 意味着斜率绝对值越大,反应焓变的绝对值越大,温度对平衡的影响越显著。
意味着斜率绝对值越大,反应焓变的绝对值越大,温度对平衡的影响越显著。
范特霍夫方程在工业生产实践中的应用
工业生产的核心诉求是实现“高产率、高纯度、低能耗”,范特霍夫方程通过精准调控温度与平衡的关系,成为解决这一诉求的关键工具,广泛应用于各类化工反应的工艺优化。
(一)优化反应温度,平衡产率与速率
工业反应需在“平衡产率”与“反应速率”间寻找最优解,范特霍夫方程提供了温度选择的科学依据:
• 对于吸热反应(如部分有机合成、纳米材料制备),根据方程规律,升温可增大K,提升原料转化率。工业制备高分子单体时,通过升温促进平衡正向移动,同时搭配耐高温催化剂保障反应速率,实现产率与效率的同步提升;
• 对于放热反应(如甲醇合成、氨合成),升温会导致K减小,平衡逆向移动。以甲醇合成为例,该反应为典型放热反应(ΔH<0,低温下K更大但反应速率极慢,工业上依据范特霍夫方程,选择400-500℃的中温区间,同时配合20-50MPa高压与高效催化剂,既弥补了低温下的速率不足,又维持了较高的平衡产率。实验数据显示,甲醇合成反应的平衡常数K温度升高显著下降,200℃时Kp,而400℃时仅为0.74atm充分印证了方程的预测规律。
(二)抑制副反应,提升产品纯度
复杂工业反应常伴随副反应,利用主副反应焓变的差异,通过范特霍夫方程调控温度,可实现主反应的选择性强化:
• 在乙二醇制备工艺中,目标反应与生成甲醇的副反应焓变不同,通过方程计算临界温度,可使目标反应的K远大于副反应,从而抑制甲醇生成,提升乙二醇纯度;
• 石油裂解过程中,裂解反应(生成乙烯、丙烯)为吸热反应,聚合副反应为放热反应,依据范特霍夫方程升温,可使裂解反应的K显著增大,聚合反应的K减小,减少产物聚合,提高烯烃产率。
(三)指导工艺设计与参数调整
范特霍夫方程为反应器设计与生产过程的动态调整提供了理论支撑:
• 在连续化生产的催化重整反应中,反应伴随温度变化,需根据方程设计反应器的温度梯度,确保各阶段K处于最优范围,维持稳定产率;
• 对于放热反应,工业上可通过冷却系统回收余热(用于预热原料),同时依据方程调控温度使平衡正向移动,实现“能耗降低+产率提升”的双重目标;
• 当原料纯度波动时,可通过方程快速计算温度调整幅度,弥补原料浓度不足对产率的影响,保障生产稳定性。
高考化学对范特霍夫方程的考查
高考化学对范特霍夫方程的考查,集中于对数形式与图像分析的结合,侧重考查学生从图像中提取信息、关联理论与实际的综合能力,以下结合2023年湖北卷与2025年四川卷真题进行解析。
(一)2023年湖北卷:反应机理与图像斜率的关联应用
该试卷的化学平衡大题以纳米碗合成为背景,聚焦反应历程与平衡常数的温度依赖性分析,核心考点为通过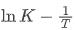 像斜率判断焓变及平衡移动。
像斜率判断焓变及平衡移动。

真题关键设问:某反应历程包含两步基元反应,其lnK与1/T的线性关系如图所示,判断两步反应的焓变正负及温度对平衡的影响。

解析思路:
1. 建立方程关联:根据范特霍夫方程的对数形式,明确图像斜率
2. 判断焓变正负:该题中两步反应的图像斜率均为负值,因此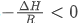 ,结合R>0可推出两步反应均为吸热反应(ΔH>0);
,结合R>0可推出两步反应均为吸热反应(ΔH>0);
3. 分析温度影响:对于吸热反应,根据方程规律,温度升高(1/T小)时,lnK大,K上升,平衡正向移动,因此升高温度有利于纳米碗的合成;
4. 特殊结论推导:题目中两步反应的图像斜率接近,根据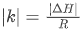 可推出两步反应的焓变绝对值相近,本质是两步反应中化学键的断裂与形成类型相似,导致焓变数值接近。
可推出两步反应的焓变绝对值相近,本质是两步反应中化学键的断裂与形成类型相似,导致焓变数值接近。
(二)2025年四川卷:多反应体系的温度调控应用
该试卷以乙二醇制备为工业背景,涉及多个竞争反应的平衡分析,核心考点为利用范特霍夫方程判断主副反应的焓变差异,进而优化反应温度。

真题关键设问:乙二醇制备过程中存在目标反应①和副反应②(生成甲醇),其lnK与1/T的关系如图所示(反应①斜率绝对值小于反应②),判断主副反应的焓变类型,并说明如何通过温度调控提高乙二醇产率。
 解析思路:
解析思路:
1. 焓变类型判断:图像中反应①和②的斜率均为正值,根据 可推出两步反应均为放热反应(ΔH<0);
可推出两步反应均为放热反应(ΔH<0);
2. 焓变大小比较:反应②的斜率绝对值更大,因此其焓变绝对值更大( ),说明副反应受温度影响更显著;
),说明副反应受温度影响更显著;
3. 温度调控策略:对于放热反应,降低温度可使K增大,平衡正向移动。由于副反应受温度影响更显著,降低温度时,反应①的K增大程度小于反应②,但副反应②的K减小幅度更大,从而使目标反应的选择性提升,乙二醇产率增加;
4. 工业逻辑关联:该设问本质是范特霍夫方程工业应用的缩影,即通过温度调控主副反应的平衡常数比,实现产品纯度的提升,与甲醇合成等工业工艺的优化逻辑一致。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在化学热力学与工业生产的交叉领域,范特霍夫方程将平衡常数与温度的抽象关系转化为可...
在化学平衡的学习中,压强对气体平衡的影响与水溶液中“越稀越电离、越稀越水解”的规...
在化学动力学研究中,基元反应是理解反应机理的 “最小单元”,而反应速率方程则是描...
在多重平衡体系中,各物质在达到平衡状态时的浓度。多重平衡体系是指一个化学反应体系...
催化反应的核心始于吸附机理——分子通过物理吸附(范德华力)或化学吸附(化学键重组...
武汉市九月调考试题 解析 一般来说,有几个 过渡态就有几个基元反应。 那么吸附或脱附...