
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、 苯酚的溶解性
审题注意1:苯酚遇水后熔点降低(纯苯酚是固体,但是苯酚遇水呈液态)
苯酚分子之间能够形成氢键(O-H⋯O),导致纯苯酚熔点高,呈现固。水分子介入以后,也可与苯酚的羟基形成氢键(O-H⋯O),破坏苯酚子间的氢键,有序结构被破坏以后,固态苯酚的稳定性被降低,导致熔下降。另外,当苯酚与水以特定比例混合时(例如,约16%水+84%苯),会形成共晶体系,混合物的熔点显著低于纯苯酚和纯水的熔点。综上两点原因,苯酚遇水呈液态。
示例思考题:利用下列实验装置能否从浑浊的苯酚水溶液中分离出苯酚?
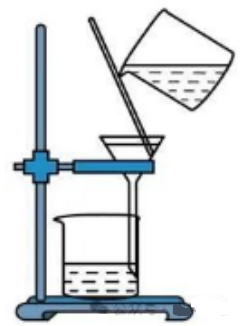
答:×
误区:纯净的苯酚是无色晶体,室温下苯酚在水中的溶解度又只有9.2g,所以,固液分离采用过滤的方法。
解析:苯酚遇水后熔点会降低,在常温下呈现液态,因而“液液分离”不能采用过滤的方法。
①分层明显时应该采用分液方法。
②乳化现象严重时:
a.可向浊液中加入NaOH溶液,苯酚与NaOH反应生成水溶性苯酚钠,溶液变澄清(苯酚钠完全溶于水)。再向水相中缓慢加入稀盐酸(HCl)至酸性(pH≈3-4),苯酚重新析出后再分液。
b.另外,还可以向浊液中加入过量NaCl,增强水的极性,降低苯酚在水中的溶解度,再分液(可以结合“加入乙醇改变水的极性,进而促进硫酸四氨合铜晶体析出”进行理解)。
教师用书注解:“苯酚溶于水形成的浊液一般是乳浊液,静置后能观察到明显的分层现象。”所以,教学时讲解为分液即可,但后续思路的拓展仍然有必要。
审题注意2:苯、甲苯、苯酚、三溴苯酚结构相似,可互溶。
示例思考题1:利用下列实验装置能否分离苯和苯酚?
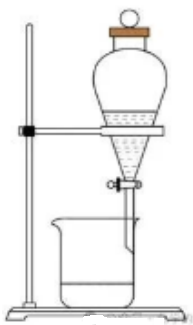
答:×
解析:苯和苯酚互溶,不能采用分液的方法分离。
示例思考题2:利用下述实验装置能否分离出苯中的少许苯酚
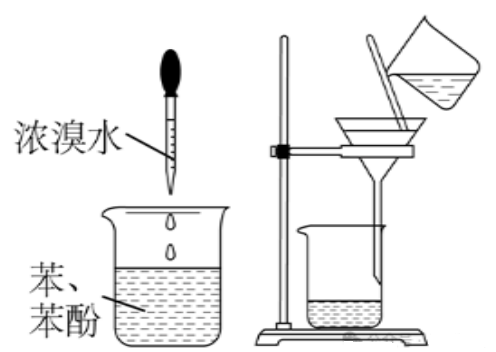
答:×
解析:苯酚产生的2,4,6-三溴苯酚,难溶于水,易溶于有机溶剂苯,恰苯又是过量的,故三溴苯酚和苯酚会互溶,无法除去苯酚。
可向苯和苯酚的混合溶液中加入NaOH溶液,充分振荡,静置,分液,得到上层液体为苯。
示例思考题3:利用下述实验装置能否检验苯中含有的少量苯酚
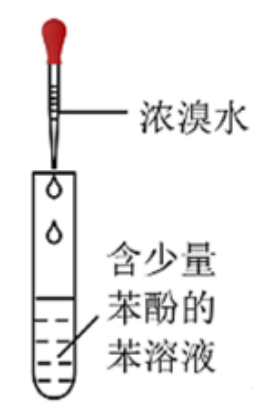
答:×
解析:浓溴水与苯酚生成三溴苯酚,三溴苯酚在水中是沉淀,但可以溶于,因此看不到白色沉淀,故而无法检验。
拓展思考1:乙醇中混有少许苯酚,能否用浓溴水进行检验?
答:×
解析:三溴苯酚与乙醇也是互溶的,看不到白色沉淀生成。
拓展思考2:检验甲苯中混有的少许苯酚,能否用浓溴水?
答:×
解析:三溴苯酚与甲苯也是互溶的,看不到白色沉淀生成。
拓展思考3:

本实验所使用的苯酚溶液的浓度要小,溴水的浓度要尽量大一些,以免生成的三溴苯酚溶于过量的苯酚中观察不到沉淀的生成。
拓展思考4:利用下述实验装置能否检验苯酚?
答:×
解析:一方面,溴浓度过低时,可能仅生成单溴代或二溴代苯酚(如4-溴苯酚),这些产物易溶于水,无法形成明显沉淀。另一方面,向苯酚溶液滴加稀溴水,生成的2,4,6—三溴苯酚溶解在过量的苯酚溶液也看不到明显现象。
二、苯酚的酸性
审题注意1:比较苯酚和其他酸的酸性强弱时,注意挥发性酸的干扰如何比较醋酸、碳酸与苯酚的酸性(选择性必修3教材实验)

醋酸会挥发,所以中间要用碳酸氢钠溶液加以去除。
审题注意2:常温下,酸碱指示剂无法检验苯酚的酸性
示例思考题:常温下,向浓苯酚溶液中滴加几滴紫色石蕊溶液,溶液变红,说明苯酚显酸性?
答:×
解析:苯酚酸性很弱,常温下,饱和的苯酚溶液也无法让酸碱指示剂变色。
审题注意3:碳酸的酸性强于苯酚,苯酚的酸性强于碳酸氢根
示例思考题:向浓苯酚溶液中滴加几滴碳酸钠溶液,产生气泡,说明苯酚的酸性强于碳酸?
答:×
解析:苯酚的酸性弱于碳酸,无法生成二氧化碳和水。
三、微观结构对宏观实验的解释
审题注意1:苯环对羟基的影响——羟基断裂——苯酚的酸性
示例1:苯酚能与NaOH反应,乙醇不能
示例2:苯酚与钠反应的剧烈程度强于乙醇
示例3:苯酚能与碳酸钠溶液反应,乙醇不能
审题注意2:羟基对苯环的影响——苯环羟基邻对为上C—H断裂示例1:苯酚与浓溴水的取代反应
示例2:苯酚苯环上的氢原子比苯分子中的氢原子更容易被卤素原子取代示例3:苯酚与甲醛发生聚合反应,生成酚醛树脂
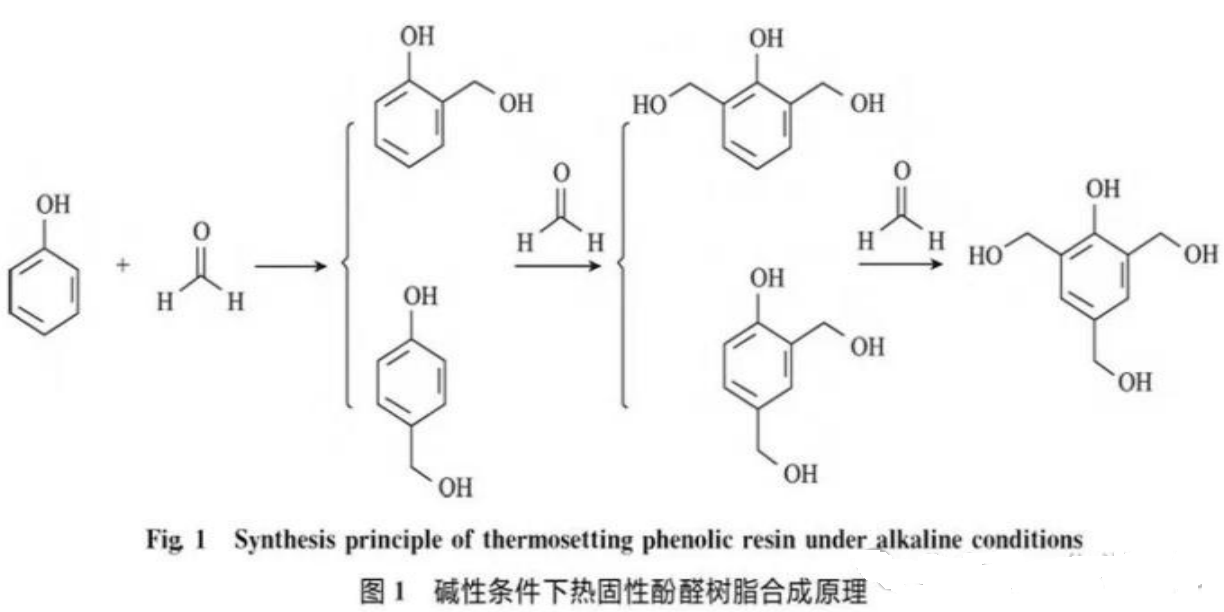
在酚醛树脂合成过程中,一般认为在强酸性条件下苯酚的对位比较活泼,而邻位反应活化能较高,苯酚与甲醛的缩聚反应主要通过酚羟基的对位进行反应。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
硝酸银溶液中滴加氨水先析出AgOH: AgNO 3 +NH 3 ·H 2 O=AgOH↓+N...
在做醛基的检验实验银镜反应中,实验的成败与否与配制的银氨...
银氨溶液中的成分要从微粒的角度看,二氨合银络离子、铵根离...
一、检验醛基的方法及原理 检验方法1:新制氢氧化铜溶液 实验...
一、 苯酚的溶解性 审题注意1:苯酚遇水后熔点降低(纯苯酚是...
高中课本中提到苯酚在空气中放置会被氧化成粉红色物质,由此...