
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氨基碱性强弱比较: 取决于氨基上N原子的电子云密度越大,其给出电子对的能力越强,碱性越强。
一般规律:脂肪胺>氨>芳香胺。
1.脂肪胺诱导效应:
1.脂肪胺诱导效应:当R-NH2中R基推电子的诱导效应强,N原子上电子云密度越大,越有利于结合质子,则-NH2碱性越强;若R基吸电子的诱导效应强,N原子上电子云密度越小,越不利于结合质子,则-NH2碱性越弱。
例1.
碱性:CH3-NH2>HO-NH2
解释:-CH3是诱导推电子基团,导致CH3-NH2中N原子上电子云密度增大,碱性增强;
而-OH是诱导吸电子基团,导致HO-NH2中N原子上电子云密度减小,碱性减弱。
结论:一般来说,脂肪胺中R基越多越大,推电子诱导效应越厉害,相应物质碱性越强。如R2NH>RNH2(这里未把R3N列入,主要原因是还要考虑氢键效应和位阻效应,具体练习里分析。)
2.芳香胺的共轭效应:
例2.
碱性:CH3-NH2>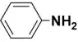
解释: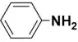 中苯环与N原子p电子参与p-π共轭效应,将N原子电子分散到苯环一端,使N原子电子云密度降低,碱性较弱。如:
中苯环与N原子p电子参与p-π共轭效应,将N原子电子分散到苯环一端,使N原子电子云密度降低,碱性较弱。如: 。
。
结论:NH3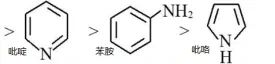
(1)
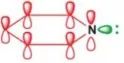
N上孤电子对未形成环的共轭体系,N上电子云密度没有分散,碱性较强。
(2)

N上孤电子对参与环的共轭体系,N上电子云密度被分散,碱性变弱。
(3)
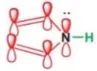
N上孤电子对形成环的π共轭体系。N上电子云密度降低,碱性最弱。
3.电负性效应:
X-NH2中X电负性越强,则X-N共用电子点偏离N,N上电子云密度降低,碱性减弱。
例3.碱性:NH3>N2H4
解释:电负性N>H,H2N-NH2中N-N共用电子对未偏移,而H-NH2中H-N键共用电子对偏向N,导致H-NH2中N上电子云密度增大,碱性增强。故碱性NH3 >N2H4。
练习.判断碱性大小:
(1)CH3-NH2 (CH3)2-NH2
(2)CH3-NH2 (CH3)3N
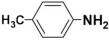
(3)
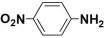
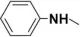
(4)
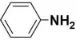
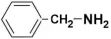
(5) 
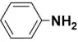
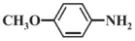
(6)
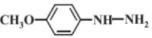
(7)NH2OH NF3
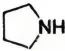
(8)
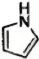
(9)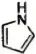
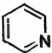
(10)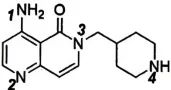 中4个N原子碱性由强到弱顺序 。
中4个N原子碱性由强到弱顺序 。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
到底什么是酸酐,什么又是柠檬酸酐呢? 酸酐实际就是某含氧酸...
吸电子基团 (EWG) 与推电子基团 (EDG) 详细对比原理图 吸电子基团...
要理解溴的四氯化碳溶液不能与饱和醛发生反应,核心在于反应...
酸酐(Acid Anhydride)是一类在无机化学与有机化学中均具有重要...
一、电子效应:官能团的“性格”密码 在比较酸性前,必须先理...
有机氰化物是指分子中含有氰基(-CN,氰基中 C 与 N 以三键连接...