
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机氰化物是指分子中含有氰基(-CN,氰基中 C 与 N 以三键连接:C≡N)的有机化合物,通式可表示为 R-CN(R 为烷基、芳基、烯基等烃基或其他官能团取代基)。作为高考有机化学的核心考点之一,其性质兼具官能团的特殊性与有机化合物的通性,以下从结构基础、物理性质、化学性质、毒性与应用、高考考点对比五个维度展开详细解析,附具体反应方程式和教学重点标注。
一、结构基础:氰基(-CN)的成键特点与杂化类型
1. 核心结构
氰基中碳原子采取sp 杂化,其中 1 个 sp 杂化轨道与烃基 R 形成 σ 键,另 1 个 sp 杂化轨道与氮原子的 sp 杂化轨道形成 σ 键;碳原子剩余的 2 个未杂化 p 轨道与氮原子的 2 个未杂化 p 轨道平行重叠,形成 2 个 π 键,最终构成C≡N 三键(键长约 116 pm,键能约 891 kJ/mol,键能高于 C=C 和 C-C 键)。
2. 电子云分布与极性
氮原子电负性(3.04)大于碳原子(2.55),电子云强烈偏向 N 原子,使氰基具有强吸电子诱导效应(-I) 和弱吸电子共轭效应(-C)。
氰基的极性导致 R-CN 分子具有一定偶极矩(如乙腈偶极矩 μ=3.92 D),使其在极性溶剂中具有一定溶解性。
3. 结构与性质的关联(教学关键点)
强三键结构:化学性质相对稳定,但在特定条件(如酸、碱、催化剂)下可发生加成、水解、还原等反应(高考高频反应类型)。
吸电子特性:使相连的烃基(如 α- 碳原子上的 H)具有一定酸性,可发生亲核取代、缩合反应。
二、物理性质(高考常考对比点)
性质类型 | 具体特点 | 典型物质示例(高考常考) | 考点应用场景 |
|---|---|---|---|
状态(常温常压) | 低级脂肪族氰化物(R 为 1-4 个 C)为无色液体;高级脂肪族(≥5 个 C)和芳香族为固体 | 乙腈(CH₃CN):液体;苯甲腈(C₆H₅CN):固体 | 有机物状态推断、分离提纯(蒸馏) |
溶解性 | 易溶于极性有机溶剂(乙醇、乙醚、丙酮、DMF);低级氰化物(乙腈、丙腈)可与水互溶,随碳原子数增加,水溶性迅速下降 | 乙腈:与水任意比互溶;戊腈(C₅H₁₁CN):难溶于水 | 除杂实验设计、溶剂选择判断 |
沸点 / 熔点 | 沸点高于同碳原子数的烷烃、烯烃(因偶极 - 偶极相互作用),低于同碳数的羧酸、醇(无氢键) | 乙烷(沸点 - 88.6℃)<乙腈(81.6℃)<乙醇(78.3℃) | 沸点比较、蒸馏分离条件选择 |
气味 | 低级氰化物有特殊刺激性气味(如丙烯腈有杏仁味),芳香族氰化物气味较淡 | 丙烯腈(CH₂=CH-CN):刺激性杏仁味 | 物质检验题中的气味特征推断 |
密度 | 脂肪族氰化物密度略小于水(如乙腈 0.786 g/cm³),芳香族氰化物密度大于水(如苯甲腈 1.010 g/cm³) | 苯甲腈(1.010 g/cm³)>水(1.00 g/cm³) | 分层实验中有机层位置判断 |
教学小贴士:
引导学生通过 “结构决定性质” 推导:氰基的极性→溶解性、沸点差异;分子间作用力(无氢键)→沸点低于醇 / 羧酸,高于烷烃 / 烯烃。
对比记忆:将乙腈与乙醇、乙烷的物理性质对比,强化 “官能团对物质性质的影响” 这一核心逻辑。
三、化学性质(高考核心考点,附反应方程式与应用)
有机氰化物的化学性质主要围绕氰基(-CN)的反应展开,同时受烃基 R 的结构影响(如不饱和烃基的加成、芳基的亲电取代等),以下是高考高频反应类型:
1. 水解反应(重中之重,常考酸性 / 碱性条件对比)
氰基在酸或碱催化下发生水解,最终生成羧酸(酸性条件)或羧酸盐(碱性条件),中间产物为酰胺(RCONH₂),反应分两步进行:
(1)酸性水解(高考主流考点)
反应方程式:
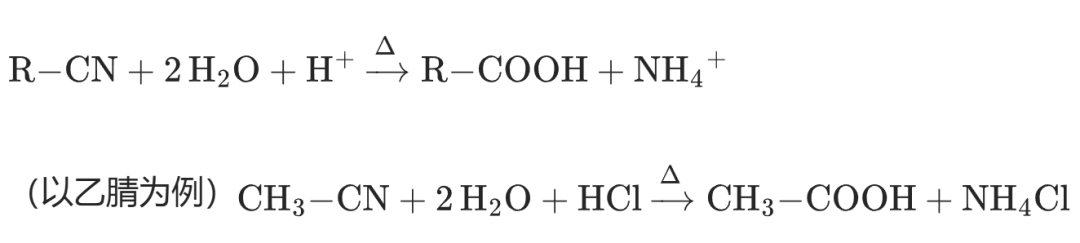
反应机理:
氰基中 N 原子质子化(吸电子诱导效应使 N 易接受质子),增强 C 原子的亲电性;
水分子进攻 C 原子,三键打开,生成亚胺酸;
亚胺酸水解生成酰胺;
酰胺进一步水解生成羧酸和铵盐。
(2)碱性水解
反应方程式:
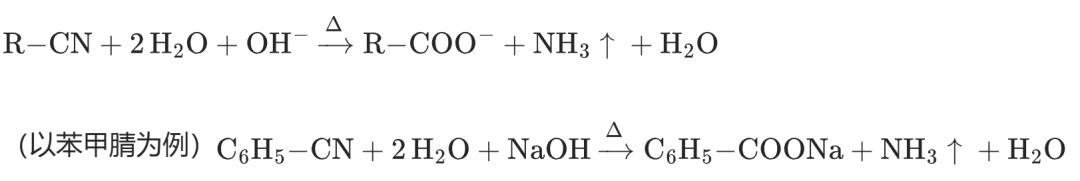
考点对比:
条件 | 产物 | 反应现象 | 高考应用场景 |
|---|---|---|---|
酸性水解 | 羧酸(R-COOH)+ 铵盐 | 无气体生成,溶液呈酸性 | 羧酸制备、有机推断题中官能团转化 |
碱性水解 | 羧酸盐(R-COONa)+ NH₃↑ | 产生刺激性气体(NH₃) | 气体检验、除杂实验设计 |
2. 还原反应(常考与醛 / 胺的转化)
氰基可被还原为伯胺(-CH₂NH₂)或醛(-CHO),还原试剂不同,产物不同:
(1)完全还原(生成伯胺,高考高频)
催化剂加氢(工业常用,高考常考反应条件):
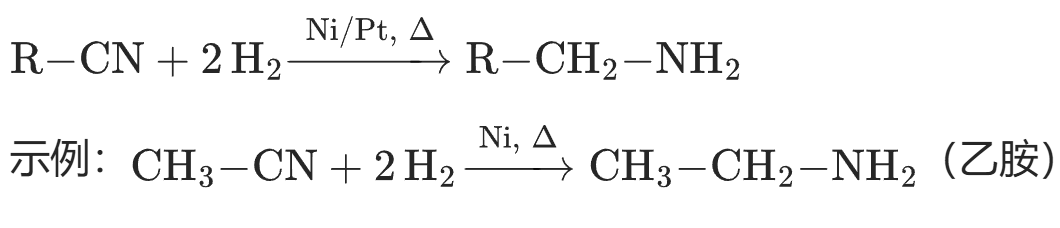
金属氢化物还原(如 LiAlH₄,无水条件):
![]()
(2)部分还原(生成醛,高考冷门但需掌握)
温和还原剂(如 DIBAL-H,二异丁基氢化铝):

考点提示:
区分 “完全还原” 与 “部分还原” 的试剂和产物,避免混淆(如 LiAlH₄还原生成胺,DIBAL-H 还原生成醛)。
伯胺的制备是高考有机合成题的常见步骤(如从氰化物合成脂肪胺、芳香胺)。
3. 亲核加成反应(氰基的不饱和性)
氰基(C≡N)具有不饱和三键,可与亲核试剂(如格氏试剂、醇、水等)发生加成反应:
(1)与格氏试剂加成(高考常考,制备酮)
反应方程式:
![]()
(R' 为烷基、芳基;最终产物为酮)
示例:
![]()
反应逻辑:格氏试剂(R'-MgX)作为亲核试剂进攻氰基的 C 原子,三键打开,水解后氰基转化为羰基(C=O),生成酮类化合物。
(2)与醇加成(制备氰醇醚,高考低频)
![]()
(亚胺醚),进一步水解可生成酯。
4. α- 氢的反应(脂肪族氰化物的特性)
氰基的强吸电子诱导效应使 α- 碳原子(与 - CN 直接相连的 C 原子)上的 H 具有酸性(pKa≈25),可在强碱(如 NaNH₂、LDA)作用下形成碳负离子,发生缩合反应(如 Knoevenagel 缩合,高考选考考点):
示例:
![]()
(丙二腈与醛的缩合,生成不饱和腈)
5. 与不饱和烃基的协同反应(如丙烯腈的加聚)
当 R 为不饱和烃基(如烯基、炔基)时,氰基与不饱和键可协同参与反应,最典型的是丙烯腈的加聚反应(高考常考高分子合成):
![]()
(聚丙烯腈,腈纶的主要成分)
考点应用:
高分子材料合成题中,丙烯腈常与丁二烯、苯乙烯共聚(如 ABS 树脂:丙烯腈 - 丁二烯 - 苯乙烯共聚物)。
四、毒性与应用(高考常识性考点)
1. 毒性机制与危害(常考安全防护)
毒性原理:有机氰化物进入人体后,氰基(-CN)可抑制细胞色素 c 氧化酶的活性,阻断细胞呼吸链,导致组织缺氧(与无机氰化物如 NaCN 毒性机制相同,但毒性相对较弱)。
常见有毒有机氰化物:丙烯腈(剧毒,LD₅₀=78 mg/kg)、氰化苄(中等毒性)、乙腈(低毒,但过量摄入仍可中毒)。
中毒症状:头痛、恶心、呼吸困难、抽搐,严重时昏迷死亡;急救措施:立即脱离现场,吸入亚硝酸异戊酯或注射硫代硫酸钠溶液(高考常考急救方法)。
2. 主要应用(联系工业生产,高考情境题背景)
应用领域 | 典型物质 | 用途说明 | 高考情境示例 |
|---|---|---|---|
合成纤维 | 丙烯腈(CH₂=CH-CN) | 聚合生成聚丙烯腈(腈纶) | 高分子合成题中 “合成腈纶” 的原料 |
有机合成 | 乙腈、苯甲腈、丙二腈 | 制备羧酸、胺、酮、酯等化合物 | 有机推断题中 “从氰化物合成目标产物” |
溶剂 | 乙腈(CH₃CN) | 极性有机溶剂,用于色谱分析、有机反应溶剂 | 实验题中 “选择合适溶剂溶解有机物” |
医药 / 农药 | 氰基乙酸乙酯(NC-CH₂-COOC₂H₅) | 合成维生素 B6、除草剂等 | 有机合成题中 “医药中间体的制备” |
五、高考考点聚焦与对比分析
1. 核心考点清单(标注频次)
考点类型 | 高考出现频次 | 考查形式 | 解题关键 |
|---|---|---|---|
氰基的水解反应(酸 / 碱性) | 高频(每年 1-2 题) | 有机推断题、实验题 | 记住产物(羧酸 / 羧酸盐)、反应条件 |
氰基的还原反应(生成胺 / 醛) | 中频(每 2 年 1 题) | 有机合成题、官能团转化题 | 区分还原试剂与产物的对应关系 |
与格氏试剂的加成反应(生成酮) | 中频 | 有机合成题(制备酮类化合物) | 掌握反应机理与产物结构 |
丙烯腈的加聚反应(合成腈纶) | 低频但必考 | 高分子材料题、化学与生活题 | 写出加聚反应方程式,识别单体 |
物理性质对比(溶解性、沸点) | 低频 | 选择题、实验题(分离提纯) | 结合官能团极性、分子间作用力分析 |
毒性与安全防护 | 冷门(偶尔出现) | 选择题、实验题(安全操作) | 记住中毒机制与急救措施 |
2. 易混淆知识点对比(教学难点突破)
易混淆点 | 正确结论 | 常见错误 |
|---|---|---|
氰基(-CN)与异氰基(-NC) | -CN 的 C 与 R 相连(R-CN),-NC 的 N 与 R 相连(R-NC),性质不同(如 R-NC 水解生成胺和甲酸) | 混淆结构,认为两者性质相同 |
氰基水解的产物 | 酸性条件→羧酸;碱性条件→羧酸盐(需酸化生成羧酸) | 误认为碱性水解直接生成羧酸 |
还原试剂的选择 | LiAlH₄→伯胺;DIBAL-H→醛;H₂/Ni→伯胺 | 用 LiAlH₄还原生成醛,或用 DIBAL-H 生成胺 |
有机氰化物与无机氰化物的毒性 | 均抑制细胞色素 c 氧化酶,但有机氰化物毒性相对较弱(需代谢转化为 CN⁻才有毒) | 认为有机氰化物无毒或毒性与 NaCN 完全相同 |
3. 典型高考真题示例(2023 年全国卷改编)
题目:化合物 X(C₂H₃N)是一种重要的有机合成原料,其结构简式为________;X 在酸性条件下水解的产物为________(填结构简式);X 与 H₂在 Ni 催化下反应生成的有机产物的名称为________。
答案:CH₃-CN(乙腈);CH₃-COOH(乙酸);乙胺(CH₃CH₂NH₂)解析:根据分子式 C₂H₃N,结合氰基的组成(-CN 含 1 个 C、1 个 N),剩余 1 个 C 和 3 个 H,故为 CH₃-CN;酸性水解生成乙酸,催化加氢生成乙胺。
六、教学辅助可视化建议
1. 思维导图(核心知识框架)

2. 反应方程式总结表(便于学生记忆)
反应类型 | 反应方程式(通式 / 示例) | 反应条件 | 产物用途 |
|---|---|---|---|
酸性水解 |
| 加热、盐酸催化 | 制备羧酸 |
碱性水解 |
| 加热、氢氧化钠催化 | 制备羧酸盐,酸化得羧酸 |
催化加氢还原 |
| 镍催化剂、加热加压 | 制备伯胺 |
格氏试剂加成 |
| 无水乙醚、酸化水解 | 制备酮类化合物 |
加聚反应 |
| 引发剂(如偶氮二异丁腈) | 合成腈纶(聚丙烯腈) |
3. 实验现象对比表(实验题备考)
实验操作 | 现象描述 | 结论 / 反应类型 |
|---|---|---|
向乙腈中加入稀盐酸,加热回流 | 无气体生成,冷却后加 NaOH 溶液呈碱性,加入酚酞变红 | 酸性水解生成乙酸(羧基显酸性) |
向苯甲腈中加入浓 NaOH 溶液,加热 | 产生刺激性气体(NH₃),能使湿润的红色石蕊试纸变蓝 | 碱性水解生成苯甲酸钠和 NH₃ |
向丙烯腈中通入 H₂,Ni 催化加热 | 气体吸收,产物能与盐酸反应生成盐 | 还原反应生成丙胺(伯胺显碱性) |
向乙腈中加入格氏试剂(CH3MgBr),无水乙醚环境 | 生成白色沉淀,水解后有丙酮的特殊气味 | 亲核加成反应生成酮类 |
七、教学建议
结构先行:
先讲解氰基的 sp 杂化、极性特征,再推导物理性质(溶解性、沸点)和化学性质(吸电子导致 α-H 酸性、三键的加成 / 水解 / 还原),符合 “结构决定性质” 的化学核心逻辑。
对比教学:
将氰基的水解与酯的水解、酰胺的水解对比;将还原反应与醛酮的还原对比;将物理性质与同碳数的烷烃、醇、羧酸对比,强化学生的知识迁移能力。
强化方程式:
要求学生熟练书写氰基水解(酸 / 碱性)、还原(不同试剂)、加聚的反应方程式,标注反应条件和产物结构,避免因结构简式错误失分。
联系实际:
结合腈纶、医药中间体等工业应用,设计 “从原料到产物” 的有机合成路线题,提升学生的综合应用能力。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。有机氰化物是指分子中含有氰基(-CN,氰基中 C 与 N 以三键连接:C≡N)的有机化合物...
有机化学中的还原反应是高考核心考点之一,其本质是有机分子得到电子(或化合价降低,...
【导读】环氧乙烷与HO的反应是亲核加成反应,其本质是环氧乙烷的三元张力环(不饱和体...
在干燥的HCl气体或无水强酸催化下,醛不仅能与两分子的一元醇发生亲核加成—取代反应...
为什么硫醇和硫酚酸性大于相对应的醇和酚,主要有以下两个原因: 硫醇和硫酚中的硫,...
一、吡咯的结构 氮原子的杂化:氮原子采用sp杂化,形成2个σ键(与相邻碳原子)和1个...