
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在平衡体系中增大某一反应物的浓度会使平衡向正反应方向移动。但生成物在平衡混合物中的百分含量并不一定增大。因为增大反应物的浓度,必须会使平衡时反应混合物的总物质的量增加。因此生成物在平衡混合物中的百分含量是否增大通过计算作出回答。
例:对于反应CO+H2O(气)![]() CO2+H2。起始时CO,H2O的浓度都是4mol/L,(注起始时只有CO和H2O)达到平衡时H2和CO的浓度为1mol/L,然后将H2O(气)的浓度增至3mol/L,达到平衡时,CO的浓度为0.53mol/L,求两次平衡CO,H2O的转化率,和CO2在平衡混合物中的百分含量。
CO2+H2。起始时CO,H2O的浓度都是4mol/L,(注起始时只有CO和H2O)达到平衡时H2和CO的浓度为1mol/L,然后将H2O(气)的浓度增至3mol/L,达到平衡时,CO的浓度为0.53mol/L,求两次平衡CO,H2O的转化率,和CO2在平衡混合物中的百分含量。
解:第一次平衡过程:
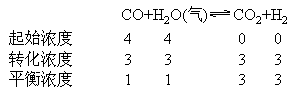
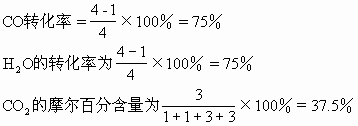
第二次平衡过程:

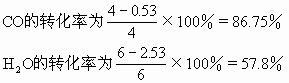
CO2的摩尔百分含量为
![]()
答:略。
通过上面的例题说明当增加反应物H2O(气)的浓度,平衡向正反应方向移动,使另一反应物CO的转化率由75%提高到86.75%(工业上可以利用这一原理采用增大廉价反应物的浓度增加一些贵重原料的利用率),而H2O自身的转化率由75%下降到57.8%。生成物的浓度由3mol/L增加到3.47mol/L。反应中CO2的摩尔百分含量由37.5%降至34.7%。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
活化分子百分数和活化分子数,理解它对掌握化学反应速率至关...
化学反应的焓变越大,代表这个反应受温度变化的影响越大吗?...
在化学热力学和分析化学中,我们常常听到这样的说法:“如果...
...
一、 什么是活化能? 活化能,通常用符号Ea表示,其标准单位为...
一、基本定义 (一)中间体 1、根据国际纯粹与应用化学联合会...