
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素周期表中规律较多,经笔者总结归纳,主要表现在以下几个方面,希望对读者有所启示.
一、数量规律
1.元素种数规律:
(1)各周期元素的种数与周期数的关系
设m 代表元素种数,n 代表周期数.
①当 n 为奇数时,m=(n+1)2/2
②当 n 为偶数时,m=(n+2)2/2
如,求第一周期包含的元素种数(x),
应用规律 1①得,x=(n+1)2/2=(1+1)2/2=2,第二周期包含的元素种数(y),y=(n+2)2/2=(2+2)2/2=8
(2)一般来说,族序数- 2= 本族非金属元素的种数(ⅠA 族除外);
(3)第ⅢB 族含元素种类最多(32 种).
2.相邻周期同主族元素原子序数关系
设 A、B 为同主族两元素,A 的原子序数为x,A 和 B 所在周期包含元素种类分别为 m 和 n.
(1)如果A、B 同在过渡元素左边,当 B 在A 的上一周期时,B 的原子序数为 x- n;当 B 在A 的下一周期时,B 的原子序数为 x+m .
(2)如果A、B 同在过渡元素右边,当 B 在A 的上一周期时,B 的原子序数为 x- m;当 B 在A 的下一周期时,B 的原子序数为x- n .
3.序数等值规律:
①原子序数 = 质子数= 核电荷数 = 原子核外电子数
②周期序数 =原子核外电子层数
③主族族序数 = 最外层电子数 = 主族价电子数= 主族元素最高正价数.
二、元素属性判断规律
1.从族序数和周期数判断元素属性规律:若主族元素 A 的族序数为 m,周期数为 n,则:
①m/n< 1 时,A 为金属,且m/n值越小,其金属性越强.
②m/n> 1 时,A 为非金属,且m/n值越大,其非金属性越强.
③m/n=1 时,A 元素的性质具有两性(H 除外)
2.从最外层电子数判断元素属性规律:
①最外层电子数为 1 的元素:主族(ⅠA 族)、副族(ⅠB、Ⅷ族部分等);
②最外层电子数为 2的元素:主族(ⅡA 族)、副族(ⅡB、ⅢB、ⅣB、ⅦB族等);
③最外层电子数为 3- 7 的元素:主族元素;
④最外层电子数为8 的元素:零族(He 除外).
三、元素性质递变规律
1.同周期元素性质递变规律:从左至右,元素的金属性逐渐减弱,非金属性逐渐增强;
2.同主族元素性质递变规律:从上至下,元素金属性逐渐增强,非金属性逐渐减弱;
3.“三角” 规律:若 A、B 处于同周期,A、C处于同主族的位置,如图所示:
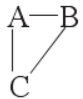
则有以下规律:①原子半径:C>A,A>B;②金属性:C>A,A>B;非金属性:B>A,A>C.
四、元素性质相似性规律
1.相邻相似:元素周期表中,相邻位置的元素其性质差别不大;
2.同主族相似:元素周期表中,同主族元素其性质具有相似性;
3. 对角线规律:金属与非金属分界线对角(左上角有右下角)的两主族元素性质相似(主要表现在第 2、3 周期,如:Li 和 Mg、Be 和 Al、B和 Si).
五、粒子半径大小规律
1. 原子半径:同主族———从上到下逐渐增大;同周期———从左到右逐渐减小(零族除外).
2.离子半径:同主族———同价离子从上到下逐渐增大;同周期———阴离子半径大于阳离子半径;具有相同的电子层结构的离子———核电荷数越大,离子半径越小.
3.同种元素的各种微粒,核外电子数越多,半径越大;反之,核外电子数越少,半径越小(如r(Fe)>r(Fe2+)>r(Fe3+)).
4.经验规律:“阴上阳下,径小序大”规律.即,与稀有气体元素同周期的阴离子、该稀有气体元素下一周期的元素的阳离子以及该稀有气体元素原子,三者具有相同的电子层结构.原子序数越大,则粒子半径越小.
六、常见元素化合价规律
1.同周期元素主要化合价:最高正价由+1→+7(稀有气体为 0 价)递变、最低负价由 - 4→- 1 递变;
2. 关系式:
①|最高正价|+|最低负价|=8(O、F 除外);
②主族族序数 = 最外层电子数 =主族价电子数= 主族元素最高正价数.
3. 化合价上的特殊规律:
①金属元素无负价,除零价外,在化合物中只显正价;
②氟无正价,氧无最高正价;氟除零价外,只显负价,氧只有和氟结合时才显正价,如在OF2中 O 显 +2 价.
4.经验规律:“价奇序奇,价偶序偶”规律.
除个别元素外 (如氮元素),若主族序数为偶数,则这族所有元素的原子序数、最高正化合价常为偶数;若主族序数为奇数,则这族所有元素的原子序数、最高正化合价常为奇数.如:硫元素原子序数为偶数(16),则其常见化合价为:- 2、0、+4、+6;氯元素原子序数为奇数(17),则其常见化合价为:- 1、+1、+3、+5、+7.
七、奇、偶规律
1.各周期所能容纳元素的种数都是偶数.
2.对于原子核外分层排布的电子来说,排满的层拥有的电子数一定为偶数,若为奇数,则一定未排满.
3.稀有气体元素原子序都是偶数.
4.“价奇序奇,价偶序偶”规律(见上,略).
八、分界线规律
位于金属与非金属之间的分界线,右上方的元素为非金属元素,左下方的元素为金属元素,处于分界线的元素一般具有两性,可做半导体材料.
九、根据原子序数推断元素位置规律
用原子序数减去比它小而相近的稀有气体元素的原子序数,即得该元素所在的纵行数(如:第 1、2 纵行为ⅠA 族、ⅡA族,第 3- 7 纵行为ⅢB 族 - ⅦB 族,第 8- 10 纵行为第Ⅷ族,第11、12 纵行为ⅠB族、ⅡB族,第13- 17纵行为ⅢA 族 - ⅦA 族,第 18 纵行为零族);该元素所在的周期数比与它最相近的原子序数小的稀有气体元素的周期数大 。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、推理方法 1 、利用原子周围的键数推理出原子的最外层电子...
元素推断题是高考考查的热点,这类题往往将元素化合物的知识、...
一:形成8电子稳定结构的元素特点: 当最外层电子数M层小于...
一、高考再现 〔2019全国I卷〕科学家合成出了一种新化合物(如图...
本次大会出现的一些高频词汇涉及了很多化学知识,通过本文带...
离子的半径(以离子半径的单位为10-10m): 1.同种元素原子与离子比...