
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在化学元素周期表中,每种元素都有一个独特的序号,这个序号实际上就是该元素的质子数。随着原子序数的增加,元素的质子数也会相应增加。元素周期表的奇妙之处在于,元素的化学性质并非随机分布,而是严格遵循“周期性”变化的规律。为何原子序数递增时,元素的性质会呈现出如此整齐的重复性?答案隐藏在原子的微观结构与量子力学的深层规律之中。
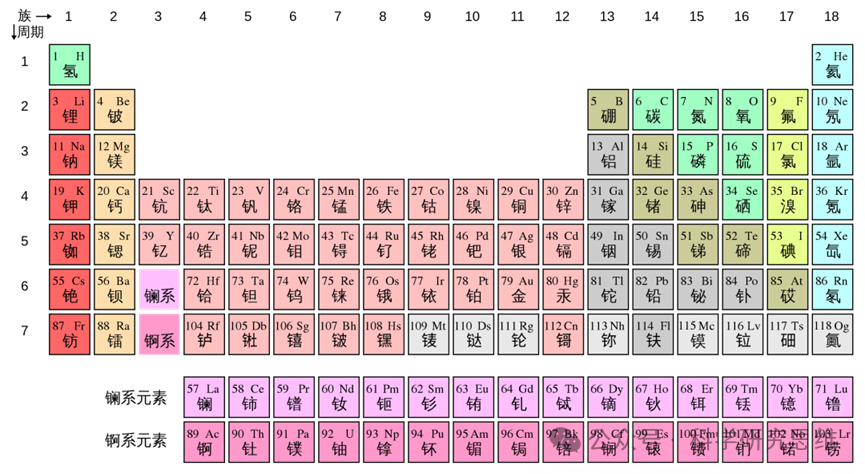
元素周期表
一、原子结构的“多层公寓”模型
由于原子是电中性的,原子中的电子数(带负电荷)总是与质子数(带正电荷)相等。质子位于原子核中,占据的空间非常小,而电子则弥散分布在原子核外的广阔空间中。
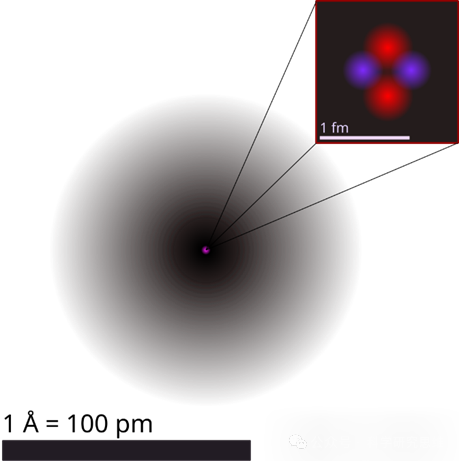
氦原子结构示意图
由于量子力学效应,电子倾向于停留在特定的区域,想象原子是一个“多层公寓”,原子核是位于中心的“物业管理处”,而电子则像租客般分布在不同楼层的“电子层”(轨道)中,电子会优先填满靠近原子核的低能级轨道,只有当这些轨道被填满后,电子才会进入更高能级的轨道。

原子轨道示意图
每个电子层(主量子数n)就像一层楼,最多能容纳的电子数遵循2n²的规则:
• 第一层(n=1):最多2个电子(1s轨道)
• 第二层(n=2):最多8个电子(2s² 2p⁶)
• 第三层(n=3):最多18个电子(3s² 3p⁶ 3d¹⁰)
• ……以此类推。
二、量子力学:电子排布的“隐形台阶”
1. 能量最低原理:电子的“懒惰本性”
电子总是优先占据能量最低的轨道。例如:
• 锂(Li,原子序数3):前两个电子填满1s轨道,第三个电子必须进入更高能级的2s轨道。这样,锂原子的电子排布为1s²2s¹,这意味着锂原子和氢原子一样,最外层轨道上只有1个电子。
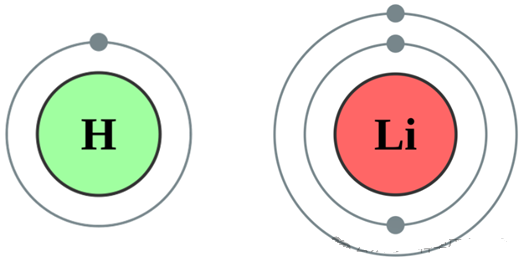
氢原子和锂原子的电子排布
• 钠(Na,原子序数11):前10个电子填满1s、2s、2p轨道,第11个电子进入3s轨道。这样,钠原子的电子排布为1s22s22p63s1,这意味着它和锂原子、氢原子一样,最外层轨道上只有1个电子。
随着原子序数的增加,旧的轨道不断被填满,新的轨道也被开辟出来。这种填充过程导致了原子最外层电子排布的周期性变化。例如,第1、2、3、4层轨道分别最多可以容纳2、8、8、18个电子。这意味着1号元素、3号元素(1+2)、11号元素(3+8)、19号元素(11+8)以及37号元素(19+18)都具有相同的最外层电子数。
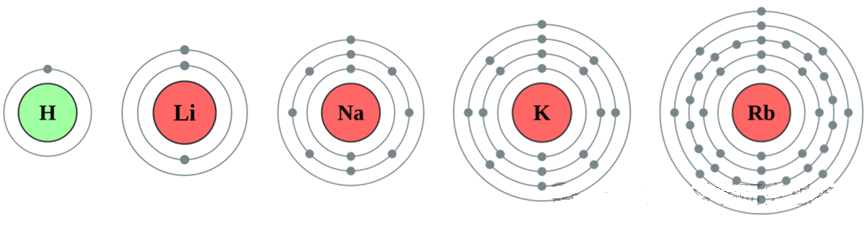
1、3、11、19、37号元素的电子排布
这种“逐层填充”的规则,使得每增加一个电子层,原子半径和化学性质都会发生显著变化。
2. 泡利不相容原理:电子的“独居习惯”
同一轨道中的电子必须满足自旋相反的条件。例如:
• 氧(O,原子序数8):2p轨道有4个电子,必须两两占据不同轨道且自旋相反。
• 氖(Ne,原子序数10):2p轨道填满6个电子后,原子达到稳定结构。
这种排布规则决定了元素的化学惰性(如稀有气体)或反应活性(如碱金属)。
3. 洪特规则:电子的“群居偏好”
当多个轨道能量相同时(如p、d、f轨道),电子会优先占据不同的轨道且自旋平行。例如:
• 碳(C,原子序数6):2p轨道有两个电子,分别占据不同轨道,为后续形成共价键奠定基础。
三、打破周期性的“意外彩蛋”
尽管元素周期律具有普适性,但仍有少数例外:
1.镧系收缩:镧系元素(57-71号)因4f电子的屏蔽效应,原子半径收缩幅度较小,导致后续元素(如铪Hf)的半径与预期不符。
2.相对论效应:重元素(如金Au、汞Hg)的6s电子因接近光速运动,质量增加导致轨道收缩,改变了它们的化学性质(如金的黄色光泽源于相对论效应引发的可见光吸收)。
3.轨道杂化:在分子中,原子轨道会重新组合(如碳的sp³杂化),导致键角和分子形状的改变,间接影响元素表现出的性质。
四、元素周期性的现实意义
在化学反应中,最外层电子的得失是最容易发生的,因此最外层的电子数(价电子数)对元素的化学性质的影响程度最大。原子最外层电子数的周期性变化,导致了元素化学性质的周期性变化。这也是为什么同一族的元素具有相似的化学性质。例如,锂(Li)、钠(Na)、钾(K)都具有很强的还原性,而氟(F)、氯(Cl)、溴(Br)则具有很强的氧化性。这种元素性质随着原子序数增加而呈现的周期性规律,就是所谓的元素周期律。
1. 指导新材料研发
·半导体材料:硅(Si)和锗(Ge)的4价特性使其成为芯片核心。
·超导材料:铜氧化物(如YBa₂Cu₃O₇)中的d轨道电子配对机制,推动了高温超导研究。
2. 解释生命现象
·血红蛋白:铁(Fe)的3d轨道能可逆结合氧气,实现氧气运输。
·叶绿素:镁(Mg)的中心地位使其成为光合作用的能量转换枢纽。
3. 解决环境危机
·催化剂设计:铂(Pt)和钯(Pd)的d轨道电子使其成为汽车尾气净化的关键。
·核废料处理:锕系元素(如铀U、钚Pu)的放射性衰变特性,推动核燃料循环技术发展。
五、总结:周期性的本质是量子世界的秩序
元素周期律的本质,是量子力学规则在原子尺度上的宏观体现。电子排布的能级分层、泡利不相容原理和洪特规则,共同编织出一张精密的“元素性质网络”。尽管存在个别例外,但周期性规律依然是化学研究的基石,也是人类理解物质世界的一把金钥匙。
正如门捷列夫所说:“科学始于元素,终于元素。” 对元素周期性的探索,不仅揭示了自然的底层逻辑,更指引着我们向材料科学、能源革命和生命奥秘的更深层次进发。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
本文将给出基于八隅律的电子式的书写步骤。与以往教学不同之...
氯离子(Cl)的半径大于铯离子(Cs)!!!课本上没有错哦!...
含氧酸是酸中的主角,常见的含氧酸中,有高某酸、正某酸、亚...
一、常见三种原子半径的标准 首先我们说说原子半径有几种不同...
【导读】键长和键能的关系在化学中通常表现为反比规律:键长...
...