
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、 证明金属性强弱的方法
(一)理论法
1、 同一主族,从上至下,金属性逐渐增强
在同一主族的元素中,由于从上到下电子层数增多,原子半径增大,核对核外电子的引力减少,失电子能力逐渐增强,得电子能力逐渐减弱,所以元素的金属性逐渐增强,非金属性逐渐减弱。
2、 同一周期,从左至右,金属性逐渐减弱
在同一同期中,各元素的原子核外子电子层数然相同,但从左到右,核电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强。因此,金属性逐渐减弱,非金属性逐渐增强。
3、根据金属活动性顺序表进行判断
金属活动性顺序表:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H) >Cu>Hg>Ag>Pt>Au
(二)实验的方法
1、与酸反应进比较
与酸反应者比不与酸反应的金属活泼(除与浓H2SO4、浓HNO3发生钝化的金属Fe、Al情况除外)
2、与盐溶液反应进行比较
活泼金属可以把不活泼的金属从它的盐溶液中置换出来
如:Fe+CuSO4=FeSO4+Cu 则金属性:Fe>Cu
3、与金属氧化物反应进行比较
金属A若能从金属B的氧化物置换出来,则A的金属活泼性大于B。
如:2Al+Fe2O3=Al2O3+2Fe 则金属性:Al>Fe
4、与水反应进行比较
钠与冷水反应激烈,镁不易跟冷水作用,镁只能跟沸水作用,反应条件比钠要求高,说明钠的金属活泼性强于镁。
5、 氢氧化物的碱性强弱进行比较
金属的氧化物的水化物——氢氧化物的碱性越强,金属的活泼性也越强。
6、 利用电化学方法进行比较。
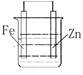
将两片金属平行地插入硫酸溶液中,再用导线连接起来,有气体生成的金属片表明此种金属的活泼性较另一片弱。
如两片金属片,一片为铁片,另一片为锌片,但分辩不清哪一片为何种金属,可按上述方法进行实验,有气体生成者可确认为铁片。
二、证明非金属性强弱
(一)理论法
1、同一主族,自上而下,非金属性逐渐减弱。
在同一主族的元素中,由于从上到下电子层数增多, 原子半径增大,核外电子的引力减弱,失电子能力逐渐增强,非金属性逐渐减弱。
2、 同一同期,从左到右,核电荷数依次增加,原子半径逐渐减小,得电子能力逐渐增强,因而从左至右非金属性逐渐增强。
(二)实验的方法
1、从跟氢气反应生成气态氢化物的难易,判断非金属性的强弱。
2、从元素气态氢化物的稳定性来判断非金属性的强弱。
元素与氢化合的难易与气态氢化物的稳定性是一致的。如卤素与氢化合典型的事例。
化学式 | 跟氢气的反应的条件 | 气态氢态物的稳定性 |
F2 | 在冷暗处就能剧烈化合而爆炸 | 很稳定 |
Cl2 | 在强光照射下,剧烈化合而爆炸 | 较稳定 |
Br2 | 在高温条件下,较慢地化合 | 较不稳定 |
I2 | 持续加热,慢慢地化合 | 很不稳定,同时发生分解 |
从表中可知反应条件越易气态氢化物越稳定,反之反应条件越苛刻气态氢化物越不稳定。
结论:非金属性F>Cl>Br>I
3、 从元素氧化物的水化物的酸性强弱判断非金属性的强弱。
如:酸性HClO4>HBrO4>HIO4 则非金属性Cl>Br>I
4、 利用化学反应进行判断
Cl2+2KBr=2KCl+ Br2 Br2+2KI=2KBr+I2
非金属性:Cl>Br>I
5、 通过与同一反应物发生反应进行间接比较
02+2Cu![]() 2CuO S+2Cu
2CuO S+2Cu![]() Cu2S
Cu2S
说明氧夺电子的能力强于硫,则非金属性O>S。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
本文将给出基于八隅律的电子式的书写步骤。与以往教学不同之...
氯离子(Cl)的半径大于铯离子(Cs)!!!课本上没有错哦!...
含氧酸是酸中的主角,常见的含氧酸中,有高某酸、正某酸、亚...
一、常见三种原子半径的标准 首先我们说说原子半径有几种不同...
【导读】键长和键能的关系在化学中通常表现为反比规律:键长...
...