
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、最高价氧化物对应水化物酸性
审题注意1:注意一定得是最高价氧化物对应水化物
示例思考题:
1)向Na2S溶液中滴加盐酸产生臭鸡蛋气味的气体,能否说明非金属性:Cl>S?
2)将盐酸滴加到亚硫酸钠固体中,把产生的气体通入品红溶液,品红溶液褪色,能否说明非金属性:Cl>S?
答:×解析:
1)只能说明酸性:HCl>H2S(强酸制弱酸),这两个酸都不是Cl和S的最高价含氧酸,所以无法比较。
2)只能说明酸性:HCl>亚硫酸(强酸制弱酸),也不是Cl和S的最高价含氧酸,所以无法比较。
审题注意2:注意盐酸、醋酸、硝酸的挥发性
示例思考题:该装置能否说明非金属性Cl>C>Si?
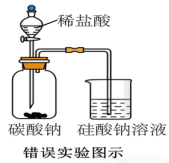
答:×
解析:盐酸滴入碳酸钠溶液中,生成二氧化碳气体,可证明盐酸比碳酸的酸性强,但不能证明非金属性Cl>C,(因为非金属性越强,最高价氧化物对应的水化物的酸性越强),盐酸当中Cl的化合价不是最高价!
盐酸与碳酸钠反应产生的二氧化碳通入硅酸钠溶液中,生成硅酸沉淀,可证明酸性碳酸>硅酸,非金属性C>Si,但挥发的盐酸也可以和硅酸钠溶液生成硅酸沉淀,所以,严谨一点,中间还得加一个去除挥发出来的盐酸的装置,如下图。
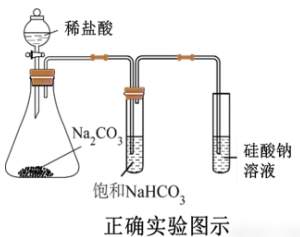
小结:上方的正确图示只能说明酸性是盐酸>碳酸>硅酸,无法说明非金属性Cl>C!
审题注意3:测pH比较物质酸性进而反推非金属性时,注意控制变量(浓度、温度等相同)
示例思考题1:常温下测得0.1mol/L硫酸溶液和0.1mol/L硝酸溶液的pH分别为0.7和1.0,能否说明非金属性:S>N?
答:×
解析:硫酸为二元酸,硝酸为一元酸,由等浓度酸溶液的pH不能比较的非金属性强弱
示例思考题2:常温下测得饱和三氧化硫溶液的pH<二氧化碳溶液的pH,能否说明非金属性:S>C?
答:×
解析:三氧化硫和二氧化碳的溶解度不同,饱和溶液的浓度不相同,所以无法比较。
审题注意4:测pH比较盐溶液酸碱性反推对应酸的酸性强弱再进而反推非金属性时,注意控制变量(浓度、温度等相同)以及“盐溶液对应的酸”
示例思考题:常温下测量0.1mol/L高氯酸钠溶液和0.1mol/L碳酸钠溶液的pH,pH:碳酸钠溶液>高氯酸钠溶液,酸性:高氯酸>碳酸,能否说明非金属性:Cl>C?
答:×
解析:碳酸钠溶液的水解以第一步为主,对应的酸是碳酸氢根,不是碳酸,所以无法得出碳酸和高氯酸的酸性强弱,进而就无法比较。
二、非金属性强的置换出非金属性弱的
审题注意1:氟单质与盐溶液置换时优先与水的反应
示例思考题:请你判断“向NaCl溶液中通入氟气,能否证明非金属性:F>Cl?
答:×
解析:F2会优先和溶液中的水发生反应,不与NaCl反应,所以无法说明。
审题注意2:涉及用量时要考虑物质氧化性、还原性强弱
示例思考题:将少量氯水滴入溴化亚铁溶液中,能否证明非金属性:Cl>Br?
答:×
解析:亚铁离子的还原性大于溴离子,将少量氯水滴入溴化亚铁溶液中,亚铁离子优先反应,不能达到实验目的。
审题注意3:非金属性的比较要注意分离的问题
示例思考题:请你判断下列实验图示能否说明元素非金属性的强弱(左:Cl>Br>S;右:Cl>Br>I)?
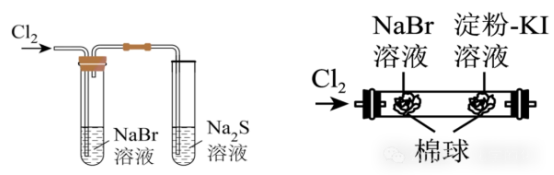
答:×
解析:Cl2和反应产生的Br2都能够与Na2S或KI在溶液中发生反应,因此都不能证明元素的非金属性:Cl>Br>S或Cl>Br>I。
审题注意4:制备粗硅反应的特殊性
示例思考题:
![]()
答:×
解析:原子半径C<Si,非金属性:C>Si。但结合氧化还原反应的规律,在该反应中C作还原剂,Si作还原产物,还原性:C>Si,恰好与原子结构的分析结果相反。其实,该反应能够进行的驱动力是因为CO的沸点比二氧化硅低(高沸点制低沸点),所以该反应无法说明非金属性:C>Si。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、金属与水(或酸)反应置换出氢气的难易程度 审题注意1:注意产物的覆盖与包裹 问...
一、金属单质与水(或酸)反应置换出氢气的难易程度 审题注意1:控制变量(形状、大...
一、最高价氧化物对应水化物酸性 审题注意1:注意一定得是最高价氧化物对应水化物 示...