
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
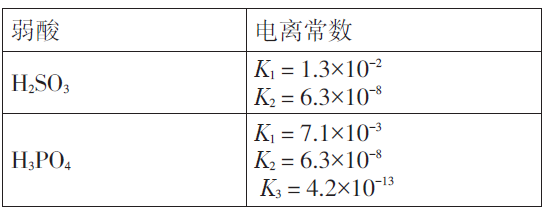
表2 几种弱酸的电离常数(25 ℃)
例3 常温下,0.1mol·L-1 NaHSO3 溶液呈( )(填“酸性”“中性”或“碱性”)?
分析:
HSO3-+H2O  H2SO3 +OH-使溶液呈碱性
H2SO3 +OH-使溶液呈碱性
HSO3- SO32- +H+使溶液呈酸性
SO32- +H+使溶液呈酸性
溶液的酸碱性取决于水解占主要的,还是电离占主要的. 如何判断两个反应谁是主要的呢?
HSO3-+H2O H2SO3+OH-(第二步水解).
H2SO3+OH-(第二步水解).
Kh =[ c(H2SO3)×c(OH-) ]÷c(HSO3-)
= [c(H2SO3)×c(OH-)×c(H+)]÷[c(HSO3-)×c(H+) ]
= [c(OH-)×c(H+)]÷[c(HSO3-)×c(H+)× c(H2SO3) ]
= Kw÷ K1
由上述推导过程易得Kh=Kw÷ K1 =7.7×10-13, HSO3-水解常数小于HSO3-电离常数,故HSO3-的电离是主要的,即NaHSO3溶液呈酸性.
同理分析:
0.1 mol·L-1NaH2PO4溶液的酸碱性. Kh(H2PO4-) = Kw÷ K1 =1.4×10-12 <K2(H2PO4-)=6.3×10-8 ,所以H2PO4-的电离是主要的,即NaH2PO4溶液呈酸性.
同理分析0.1 mol·L-1Na2HPO4溶液的酸碱性. Kh(HPO42-)= Kw÷ K2 =1.6×10-7 >K3(HPO42-)=4.2×10-13 ,所以HPO42-的水解是主要的,即Na2HPO4溶液呈碱性.
小结:由上面的推导过程,可以得到酸式盐溶液的酸碱性判断依据(其中Kn为酸式根电离常数,Kn-1为酸式根上一级电离常数):
(1)Kn-1·Kn>Kw溶液呈酸性;(2)Kn-1·Kn=Kw溶液呈中性;(3)Kn-1·Kn<Kw溶液呈碱性.

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来有没有可能是溶解度小的物...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶液中氢离子浓度([...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切相关,但二...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子 (H ) 的物质 ; 碱是 ...
电离概念是中学一个基本概念,用以区分电解质和非电解质、共价化合物和离子化合物。其...