
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
按构造原理最后填充的电子在反应中是否最先失去?
答:不一定。例如铜的电子排布式为1s22s22p63s23p63d104s1或[ Ar]3d104s1,电子先填入4s后再填入3d,在失去电子成为离子时却先失去4s电子。
定性分析:原因是失去电子成为离子,核电荷数不变电子数减少有效电荷增加,电子云的形状对电子的能量影响减小,能层n起了主要作用使4s电子能量升高,先失去4 s电子。
定量分析:多电子原子的一个电子能量计算可用如下公式:
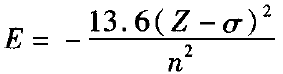
期莱脱( Slater)规则指出:σ为“屏蔽常数”,同层电子的σ =0.35(对于1s轨道电子,则σ = 0.30);若被屏蔽的电子为ns或np时,则(n一1 )层电子的σ= 0.85,更内层电子的 =1.00。
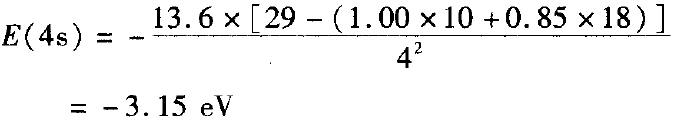
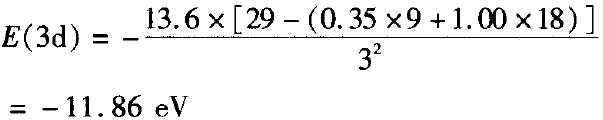
E(4s)>E(3d),首先失去4s电子。


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
原子核外电子的真实运动状态是我们肉眼看不到的,但是可以通...
铜原子(Cu)的基态电子排布为[Ar] 3d4s,失去一个电子形成亚铜...
先让大家看看高中和大学电负性的数值图:下面的人教版高中化...
在元素周期表中,除了同周期从左到右、同主族从上到下的性质...
电负性是描述原子在化合物中吸引成键电子能力的核心物理量,...
【导读】第一电离能(I)和第一电子亲和能(E)从能量变化的角度描...