
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
由于其他电子对某一电子的排斥作用而抵消了一部分核电荷,从而引起有效核电荷的降低,削弱了核电荷对该电子的吸引,这种作用称为屏蔽作用或屏蔽效应。因此,对于多电子原子来说,如果考虑到屏蔽效应,则每一个电子的能量应为:E=-13.6×(Z-σ)2/n2(eV),其中Z为原子序数,n为主量子数,σ为屏蔽常数。E值越大,则说明电子能量越高。从式中可见,如果能知道屏蔽常数σ,则可求得多电子原子中各能级的近似能量。影响屏蔽常数大小的因素很多,除了与屏蔽电子的数目和它所处原子轨道的大小和形状有关以外,还与被屏蔽电子离核的远近和运动状态有关σ屏蔽常数。可用斯莱脱提出的计算屏蔽常数的规则求得。
斯莱脱规则如下:将原子中的电子分成如下几组:(1s) (2s,2p) (3s,3p) (3d) (4s,4p) (4d) (4f) (5s,5p),如此类推。
①位于被屏蔽电子右边的各组,对被屏蔽电子的σ=0近似的可认为:外层电子对内层电子没有屏蔽作用。
②1s轨道上两个电子之间σ=0.30。其他主量子数相同的各分层电子之间的σ=0.35。
③当被屏蔽电子为ns或np时,则主量子数为(n-1)的各电子对它们的σ=0.85,而小于(n-1)的各电子对它们的屏蔽常数σ=1.00。
④被屏蔽电子为nd或nf电子时,则位于它左边各组电子对它们的屏蔽常数σ=1.00。
在计算某原子中某个电子的σ值时,可将有关屏蔽电子对该电子的σ值相加而得。
K:(1s2)(2s22p6)(3s23p6)(3d0)(4s1 ) Sc:(1s2)(2s22p6)(3s23p6)(3d1)(4s2)
如,19号K原子的价电子是3d1还是4s1,可以通过该公式计算并进行判断。如果是3d1,则σ=18×1.00=18.00,E(3d)=-1.51eV ;而如果是4s1的话,则σ=8×0.85+10×1=16.8 ,E(4s)=-4.11eV 。E(3d)>E(4s),所以价电子填充在4s轨道上,更符合能量最低原理。
表1 第四周期元素原子3d、4s轨道上电子的能量
元素 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co |
3d/eV | 3d1时 -1.51 | 3d2时 -4.11 | -13.6 | -20.13 | -27.94 | -31.98 | -47.39 | -59.03 | -71.94 |
4s/eV | 4s1时 -4.11 | 4s2时 -6.90 | -7.65 | -8.43 | -9.26 | -7.40 | -11.02 | -11.95 | -12.93 |
元素 | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
3d/eV | -86.14 | -93.12 | -118.4 | -146.6 | -177.9 | -212.2 | -249.5 | -289.9 | -333.2 |
4s/eV | -13.94 | -11.64 | -16.08 | -21.25 | -27.13 | -33.74 | -41.06 | -49.10 | -64.86 |
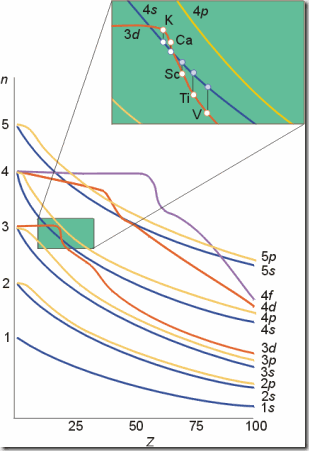
Cotton能级图 Pauling近似轨道能级图
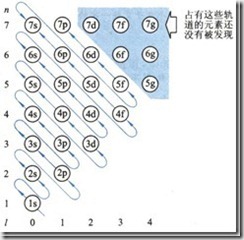
我们在填充电子的时候,使用了一个工具,在选修3将它称为“构造原理示意图”,其实它的准确名称应该是“Pauling近似轨道能级图”,在进行教学时,学生容易“错误”的理解填充的顺序一定是按照能量由高到低进行的。其实这一图形之所以是“近似”的,就是由于它没有考虑能级的能量还要受到核电荷数的影响,Cotton为了解决这一问题,通过光谱数据和理论计算绘制了更为准确的“Cotton能级图”。
取出Cotton能级图局部,可以看出当开始填充3d轨道后,4s能级的能量便下降至:E4s<E3d,所以26号Fe失去能量更高的4s电子并不超出我们的理解。
关于第四周期开头的元素 K, Ca, Sc, Ti 的最后几个电子的填充,由体系的总能量的降低程度决定, 而且, 原子的总能量不仅仅取决于某个原子轨道的能量, 尚有其它能量形式存在. 先填充哪个轨道也取决于是否使体系更加稳定.普遍认为:
1) 填充电子时, 为离子状态, Z*比原子状态的大, 体系不同
2) 先在4s上填充电子, 比先填入3d稳定, 因为4s的钻穿能力比3d大, 使电子更加靠近核,整个体系能量降低幅度大.
*Slater规则的不足之处: (nsnp)同组, 无法区分它们能量的高低.
*Pauling 近似能级图不足之处:无法反映轨道能量随与原子序数增加而下降的规律.
二者相辅相成, 各得益彰

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、为何硒酸能氧化盐酸,而硫酸不能? 在元素周期表中,同族...
一、一个“懒惰”的电子对如何改写元素命运? 在元素周期表的...
副族和Ⅷ族有什么区别? 是的,旧版教材Ⅷ族不属于副族: 2...
...
Be 的第一电离能为什么高于 B ?有的课堂对此的解释是: Be 的价...
...