
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【声明】本文适合化学竞赛学生及教师阅读,并非专为选修3模块所写
在一般情况下,电子按原子轨道能由低到高填充排布,可使体系能量最低。但是,原子轨道的能量(轨道能)随其本身及其它原子轨道的电子占据情况(库仑作用、电子自旋、轨道磁矩间作用)而动态变化,故不同元素的原子轨道能的能序不同,不能一成不变地看待。例如3d和4s轨道,作为外层轨道时的能量差得不多,但随着电子填充(当然质子数也在增大),3d与4s轨道能的变化很灵敏,于是出现了能级交错现象(见下,左图为Cotton能级图,或右图参阅某些中性原子的轨道能量的负值表):
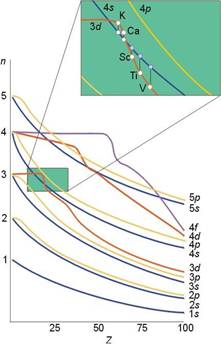
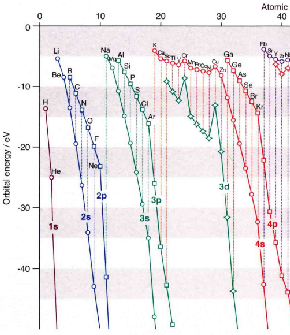
当原子序数Z =1-14,E4s>E3d,正常;Z =15-20,E4s<E3d,能级交错;Z ≥21,E4s>E3d,正常。
于此可见,有时E3d>E4s,有时E3d<E4s。例如:19K电子排布为[Ar]3d04s1,由于3d轨道上没有电子,核对4s轨道上的电子吸引力大,故E3d>E4s。又如21Sc电子排布为[Ar]3d14s2,由于内层3d轨道上有电子,对外层4s轨道上的电子有屏蔽作用,故E3d<E4s。
既然Sc的轨道能E3d<E4s,为何实际Sc原子的电子排布是先填4s,再填3d?
下面计算Sc在三种不同电子排布中:[Ar]3d14s2、[Ar]3d24s1、[Ar]3d34S0到底哪一个是能量最低的基态结构?假定三种不同电子排布中,[Ar]这部分的能量近似认为相同,这样只需计算比较外围电子排布的总能量的差异即可。见下:
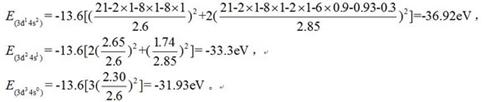
可见,基态Sc原子电子排布应是[Ar]3d14s2。尽管Sc的轨道能E3d<E4s,但如果“基态Sc原子”中的两个4s电子全部进入3d轨道成为[Ar]3d34S0,原子总能量要升高。
这是因为n相同l不同的各原子轨道中s轨道的波函数的角度分布的节面数(以下简称节面数)为零,是高度的球形对称状态,故原子体系能量最低。对于n和l均不相同的原子轨道,如4s比3d多一个单位。但4s轨道的节面数要比3d少,因此,净的结果电子填充在4s轨道上要比填充在3d轨道上使整个原子体系能量降低得更多。因而,每一周期的开始元素均是ns1-2电子排布,然后再依次填充(如第四周期元素)(n-1)d轨道上,最后以np1-6轨道电子填满结束。
或者,从径向分布函数来理解(见下图),其中K和Sc的3d与4s有明显的差异。由于Sc的3d径向分布曲线中大峰很靠近核,它的钻穿深度显著地超过4s,故3d电子间的排斥以及3d与内实电子间排斥较大,且使内实电子变得稍“松动”些,使内实电子的位能升高,3的电子能量升高。所以先填了3d“不好”,否则原子处于不稳定状态。4s电子云从整体上看比3d离核远(下右图),当有2个电子处于4s轨道上,由于4s电子比3d电子对其他电子的排斥能较低,加之4s的钻穿效应,其能量不会太高。
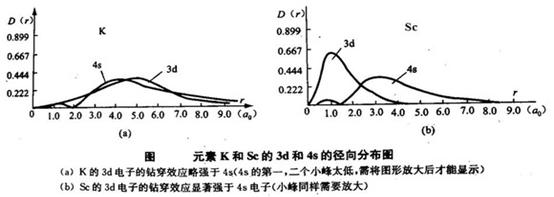
或可再简单地理解为,4s轨道填入一个电子时,3d轨道是全空的稳定态,从而使原子体系能量降低。
综上,原子中电子的排布应着眼于总能量最低为原则(这才是能量最低原理),而不应只顾及轨道能高低为次序。电子排布在能量最低的轨道时,原子体系的总能量不一定最低。这是由于核外电子之间存在相互影响(电子件的排斥能和电子自旋问题)。
有一些书上将“能量最低原理”写为:“电子在原子核外排布时,总是尽先占据能量较低的轨道,当其占满后,电子才依次进入能量较高的轨道,这样使整个原子处于能量最低、最稳定的状态”。这是不妥当的,应予以改正!
究竟按什么顺序填入,目前存在一些“模型”(注意不是定论),其中,比较吻合的就是徐光宪的“n+0.7l”规则,按n+0.7l值由小到大次序填充在前六周期总是正确,总能和能量最低原理的要求相一致,这样就可以不必顾及轨道能的高低了(当然,“n+0.7l”规则不一定代表个别轨道能高低的次序)。这就是现代元素周期系的简单电子排布规则。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
副族和Ⅷ族有什么区别? 是的,旧版教材Ⅷ族不属于副族: 2...
...
Be 的第一电离能为什么高于 B ?有的课堂对此的解释是: Be 的价...
...
...
1.原子轨道能级图 多电子体系中,电子不仅受到原子核的作用,而...