
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
许多中学化学教材对于原子核外电子的填充顺 序都有类似下面的叙述:原子核外的电子总是尽先占有能最低量的轨道,然后依次排到能量较高的轨 道,并且列出轨道能级顺序:1s,2s,2p,3s,3p,4s, 3d……(也就是我们现在说的构造原理)。核外电 子轨道的能级从第三层起,就有能级交错现象, “3d”轨道的能量高于“4s”轨道的能量,电子是在排 完“3p”而后排“4s”,再排“ 3d”……而在2009年3 月出版的人教版高中化学选修3《物质结构与性质》 第一章对构造原理的叙述:随着原子核电荷数的递增,核外电子大多是按图(即构造原理图)所示的能级顺序填充的,填满一个能级再添一个新能级。这 个规律叫做构造原理。对照这两种说法可以看到, 人教版新教材避开了提到按构造原理的顺序能量是逐渐升高的这种说法,这是为什么呢?
实际上这正是很多人对轨道填充顺序的误解所 在,很多人认为,构造原理就是原子轨道能量的高低 顺序,先填人电子的轨道能量较低,后填人电子的轨道能量较高,实际上这是对构造原理的一种误解。 构造原理指明的是核外电子的填人原子轨道顺序, 但并不是原子轨道的能量高低顺序,即先填入电子的轨道并不一定比后填入电子的轨道能量低。如果不澄清这个问题,那么冋答下面几个问题就会出现问题:
1.氢原子的3d和4s能级的能量高低是( )
A. 3d >4s; B. 3d <4s;
C. 3s=4s; D.氢原子无3d和4s轨道
2. 氢原子屮3s,3p,3d轨道能量高低的情况为( )
A. 3s <3p <3d; B. 3s =3p=3d;
C.3s>3p>3d; D.氢原子无3d和4s轨道
3. Fe原子失去两个电子成为Fe2+时,失去的是 两个4s电子还是两个3d电子?
4. H原子的1s轨道和Na原子的1s轨道哪个能量高?
也许很多人不假思索的就根据构造原理写出答案:1.A;2.A;3.3d电子;4相等。
而实际上并不是这样的,要解释这几个问题要从轨道能级分裂和能级交错产生的原因说起:
氢原子与类氢离子核外只有一个电子,这个电子只受原子核的作用,根据精确求解的单电子薛定 谔方程,电子的能量只与主量子数n有关,即E= -13.6Z2/n2 eV。因此对于氢原子与类氢离子来说, 不会发生所谓的能级分裂和能级交错,即n相同的原子轨道能量都相同(Ens= Enp = End)。
而对于多电子原子,即电子数超过两个的原子 的薛定谔方程是没有办法精确求解的,但我们吋以想办法把多电子原子简化为单电子结构。中心力场模型是一种常用的方法,这种方法的基本思想是:在多电子原子中,由于核外电子不止一个,它们之间彼 此存在相互排斥作用,而这种排斥作用的存在是会削弱原子核对电子的引力。我们把这种由于电子对 另一电子的排斥而抵消了一部分核电荷对电子的吸 引力的作用称为屏蔽作用,而把被其他电子屏蔽后 的核电荷称为有效核电荷,用符号Z 表示,于是 有:Z
表示,于是 有:Z =Z-σ。Z为未屏蔽时的核电荷数(即原子序数),σ称为屏蔽常数。σ值越大,表示目标电子 受到的屏蔽作用就越大。
=Z-σ。Z为未屏蔽时的核电荷数(即原子序数),σ称为屏蔽常数。σ值越大,表示目标电子 受到的屏蔽作用就越大。
对于氢原子Z = 1,核外只有一个电子,不存在 屏蔽效应,则其电子的能量只与主电子数n有关,而 对于多电子原子中的一个电子来说由于这时有效核电荷取代了核电荷,所以其电子的能量:
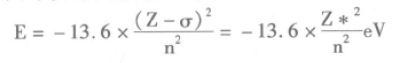
屏蔽常数如何确定呢?影响屏蔽常数的因素很 多,有产生屏蔽作用的内层电子的数目和离核远近, 还有目标电子所处的原子轨道的形状等因素。为了 估算屏蔽常数σ,斯莱特(Slater J. C)根据光谱数据归纳出一套经验规则:首先把各能级按卜面方法分成 若干组(同一括号内的能级处于同一组):(1s) (2s, 2p)(3s,3p)(3d) (4s ,4p) (4d) (4f)(5s,5p) (5d),
以此类推。这些组被认为是从核向外依次排列的
1.处在被屏蔽电子的轨道外面的轨道组σ为零。
2. 与被屏蔽电子处在同一轨道组的电子其σ为 0.35(1s组除外,它是0.30)。
3.如果被屏蔽电子处在ns或np轨道上,则(n-1) 轨道组的每个电子的σ为0.85,而更内的轨道组上的电子的σ则为1.00。
4. 如果被屏蔽电子处在nd或nf轨道上,则位 于它左边各轨道组上的电子的σ均为1.00。
由上述经验数据可估算出某原子中其他电子对 该电子的σ值,从而计算出对该电子相应的有效核 电荷Z 的值。
的值。
下面我们用这个方法计算一下K原子1s,2s, 3s,3d,4s轨道上电子的能量,结果如表1所示:

由计算结果看到,K原子的1s,2s,3s轨道电子 的能进依次升高,而3s和3d电子的能量也不再相 等。这是因为内层电子对不同形状的3s和3d轨道 的屏蔽作用不同而导致的,内层电子对3d轨道的屏蔽作用(σ=1.00)比对3s轨道(σ=0. 85)更大,导 致3d轨道电子的能量高于3s电子的能量,这就是 能级分裂现象。同理,我们也看到了 K原子最后一 个电子排在4s轨道时能量低于排在3d轨道上,也 是因为这两个轨道的形状不同,受内层电子的屏蔽 作用不同导致的,这就是能级交错现象。
下面我们再计算一下Fe原子3d,4s轨道上电 子的能量,结果如表2所示:

由计算结果看到,Fe原子的4s电子的能量髙于 3d电子,这是因为随着3d电子数目的增加,增大了对4s电子的屏蔽作用,而使4s电子的能FIT逐渐升 高,超过了 3d电子的能量,那么Fe原子失去两个电 子形成Fe2+时,失去的是两个4s电子而不是两个 3d电子就很容易理解了。
对于最后一个问题,H原子的1s轨道和Na原 子的1s轨道哪个能量高?通过上面计算我们看到 K原子的3d电子能量明显高于Fe原子的3d电子能量,这个现象可以理解为随着核电荷数的增大,原子核对相同轨道电子的吸引能力增强,因而使相同 轨道的电子更加靠近原子核,W而能遺降低了,也就 是说相同轨道的能量随着核电荷数的增加而减小。
美国化学家科顿(F. A. Cotton),总结了前人的 光谱数据和量子计算结果,画出了原子轨道能量随 着原子序数而变化的图——Cotton原子轨道能级 图,如图1所示,横坐标表示原子序数Z,左边纵坐 标表示主量子数n,右边纵坐标表示能量E。
从图中很容易看出上面我们得到的结论,原子序数为1的H元索,其主子数n相同的原子轨道能量相等,不发生能级分裂。随着原子序数Z的增 大,各原子轨道的能量逐渐降低。但是ns,np,nd,nf 等不同能级轨道能量降低幅度不同而引起了能级分裂:Ens<Enp <End〈Enf。
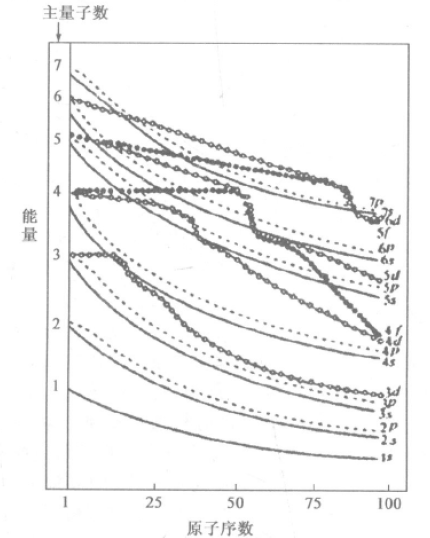
图1 COTTON原子轨道能极图
同时也使得不同元素的原子轨道的排列次序不是一成不变的,原子序数为1~8的元素,E4s>E3d; 15~20的元素E4s<E3d,而原子序数大于21的元素 E4s>E3d,至于第五周期和第六周期,一些元素原子 轨道能级变化更为特殊,甚至很多还不能用现有的 理论完美地解释。
总之,我们不能把构造原理理解成原子轨道能 量的高低顺序,它只是核外电子的填入原子轨道顺序。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、为何氮不像磷,氧不像硫? 在元素周期表中,同族元素自上...
...
原子核外电子的真实运动状态是我们肉眼看不到的,但是可以通...
铜原子(Cu)的基态电子排布为[Ar] 3d4s,失去一个电子形成亚铜...
先让大家看看高中和大学电负性的数值图:下面的人教版高中化...
在元素周期表中,除了同周期从左到右、同主族从上到下的性质...