
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、结晶
1、结晶的概念:
是物质从无序状态(如溶液、熔融态或气态)中,通过分子、原子或离子的有序排列,形成具有固定几何外形和规则内部结构的晶体的过程。
2、结晶的途径:
(1).液体→固体
熔融态物质凝固:如从熔融状态结晶出来的硫晶体
(2).气体→固体
气态物质冷却不经液态直接凝固(凝华):如凝华得到的碘
(3).溶液→固体
溶质从溶液中析出(降温或蒸发):如从硫酸铜饱和溶液中析出的硫酸铜晶体

二、蒸发结晶:
1、蒸发结晶:对于溶解度随温度变化不大的物质可将溶剂加热蒸发,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。
2、加热过程中要用玻璃棒不断搅拌,以免溶液局部过热,致使液滴飞溅。
3、当析出较多量固体时(或仅剩下少量水)时,就停止加热,利用余热把剩余的少许水蒸干。在移开酒精灯后,有晶体飞溅伤人的危险,因此不能停止搅拌。
4、如果只有一种溶质(如氯化钠),采用的蒸发结晶是将溶剂水全部蒸干。
如从氯化钠与硝酸钾混合溶液中提纯氯化钠(硝酸钾少量),此时蒸发结晶不能将溶剂全部蒸干,而是趁热过滤得到氯化钠晶体、硝酸钾与氯化钠的饱和溶液。
5、蒸发结晶的这个溶质要稳定,不能受热分解,也不能含有结晶水。
对于易分解的晶体,可采用减压或低温蒸发结晶,如NaHCO3·10H2O。
6、乙醚、CS2、CCl4等易挥发或有毒的有机物,如果直接蒸发会将有机物蒸发到空气中,这些易燃、有毒物质,影响实验室的环境及安全,所以有机溶液不采用蒸发这个方法,而是采用蒸馏的办法,且蒸馏后的有机溶剂易于处理或者回收利用。


三、降温结晶
1.降温结晶:对于溶解度随温度升高而增大的物质,先加热浓缩溶液,在较高温度下形成饱和溶液(有晶膜出现),然后进行冷却,溶解度随温度变化较大的溶质就会呈晶体析出,叫降温结晶。
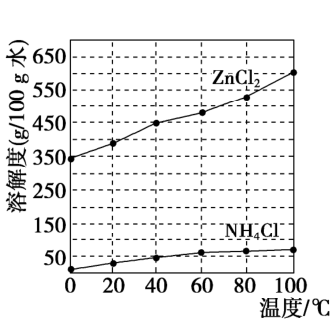
2.降温结晶适用于溶解度随温度变化较明显的物质,受热能分解的物质也只能使用降温结晶,典型的就是KNO3、KMnO4等。结晶水合物(FeCl3•6H2O、CuSO4•5H2O、FeSO4•7H2O),都只能降温析出晶体。
3.氯化镁、氯化铁、氯化铝等溶液制备对应的晶体盐时,降温结晶时,还要不断加入过量的盐酸抑制溶质的水解。
4.MgCl2•6H2O获得无水盐,将结晶水合物放在HCl气流中蒸干。CaO2•8H2O获得无水化合物,将结晶水合物放在O2气流中蒸干
5.烧杯里的溶液,倒在蒸发皿上加热浓缩。
向蒸发皿中倾倒溶液,溶液量不超过蒸发皿容积的2/3。
6.降温结晶可以用烧杯。但到把固体取出来这一步,烧杯不方便。你做一次就知道了。
7.蒸发浓缩具体操作:将溶液转移至蒸发皿中,控制温度加热至溶液表面形成一层晶膜。
8.用冷水或冰水迅速冷却并剧烈搅动溶液时,可得到颗粒很小的晶体,比表面积大,吸附的杂质多。
将热溶液在空温条件下静置使之缓缓冷却,则可得到均匀而较大的晶体。
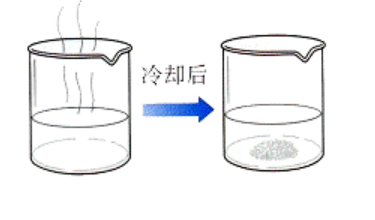
四、重结晶
1.为了得到纯度较高的晶体,把晶体移入烧杯中,再经溶解、蒸发结晶或降温结晶等步骤,重新使晶体析出,这就是我们通常所说的“重结晶”。

2.结晶的对象是溶液,溶液→析出晶体,以获得固体物质。
重结晶的对象是晶体,晶体→配成溶液→析出晶体,以使不纯净的物质获得纯化(让杂质留在溶液中或过滤掉)
3.降温结晶:蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出,叫降温结晶。
蒸发结晶:蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。
蒸发的分类:
蒸发浓缩:不饱和溶液到饱和溶液
蒸发结晶:饱和溶液结晶析出
4.硝酸钾中混有氯化钠,氯化钠中混有硝酸钾
原则:谁多,用谁的结晶方法(抓住主要矛盾)
【KNO3(NaCl)】:硝酸钾的溶解度随温度的升高而增大,且变化大,用冷却热饱和溶液的方法结晶(降温结晶)
【NaCl(KNO3)】氯化钠的溶解度随温度的升高而增大,但变化不大,用蒸发溶剂的方法结晶(蒸发结晶)
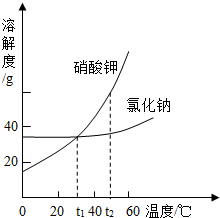
五、KNO3(NaCl)→降温结晶
1.加水溶解
2.加热浓缩(或热水配成饱和溶液)
3.降温结晶
4.过滤
5.冷水洗涤(既洗去表面的NaCl,又减少KNO3的损耗)
6.干燥
六、NaCl(KNO3)→蒸发结晶
1.加水溶解
2.加热蒸发直到析出大量晶体
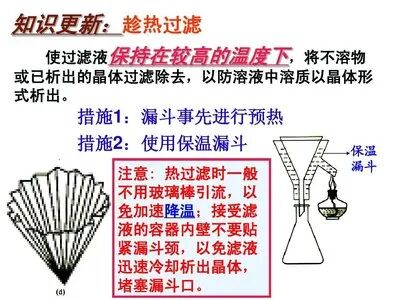
3.趁热过滤(冷却后过滤,硝酸钾溶解度变小,可能析出硝酸钾晶体)
4.热水洗涤(硝酸钾在热水中溶解度高)
5.干燥

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
蒸馏的定义:通过加热气化液体物质,冷凝其蒸汽并加以收集来...
一、减压蒸馏(减压蒸发) 1.原理 在密闭的容器内,抽真空使液...
值得关注的是咱们人教版上P87这一句: 教材的书写挺严谨的,“...
“减压,能降低大部分物质的熔沸点,通过减压,可以在加热蒸...
参考答案: 1)不能;2)吸收Cl2、防止空气中的水蒸气进入体系...
一、结晶 1、结晶的概念: 是物质从无序状态(如溶液、熔融态...