
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
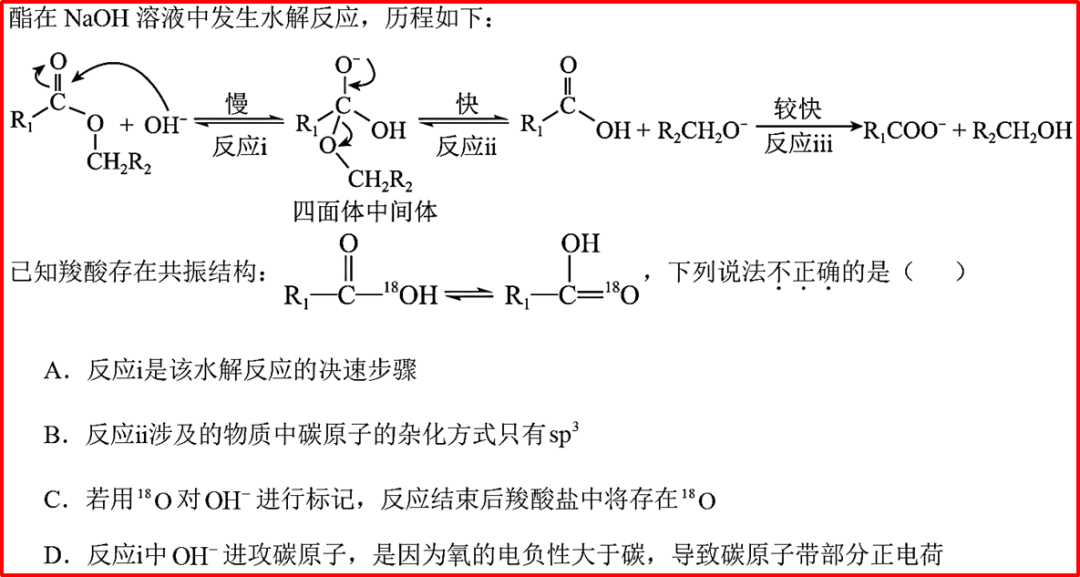
【导读】在化学中某些分子、离子或自由基无法用单一的路易斯结构式准确描述其电子分布和键合情况。共振理论应运而生,它提供了一种理解这类物种真实结构的框架。其核心思想是:当可以为一个物种写出两个或多个符合价键规则、仅电子排布不同的路易斯结构式(称为共振结构或极限式)时,其真实结构是这些共振结构的加权平均,称为共振杂化。真实结构比任何一个单独的共振结构都更稳定。
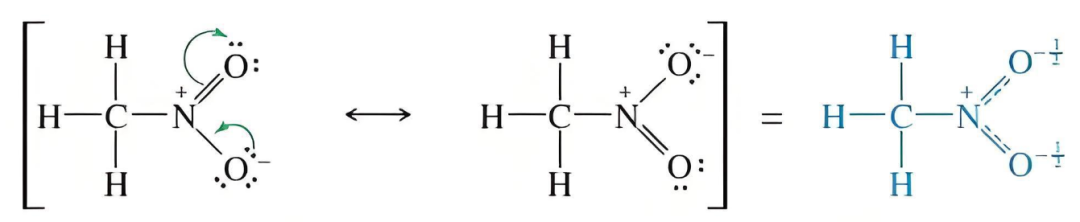
一:什么是共振结构?
共振结构是符合价键规则(如八隅体、原子价层数限制)、仅电子分布(特别是离域电子)不同的虚构的Lewis结构。它们用双箭头↔连接,表示它们共同贡献于真实结构。原子核的位置(分子骨架)在所有共振结构中必须完全相同。
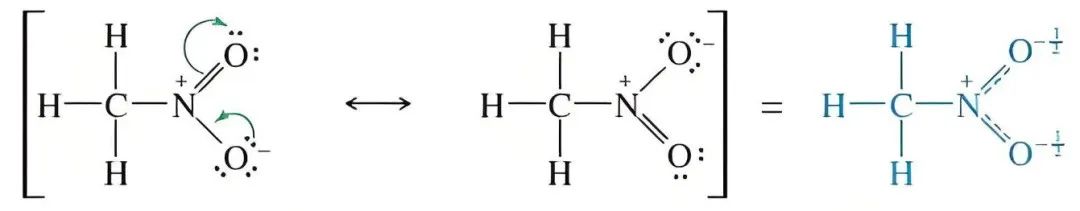
二:什么是共振杂化体?
共振杂化体是所有共振结构的加权平均,代表物种的真实、稳定结构。它通常表现为:
键长的平均化(如苯中所有C-C键等长,介于单双键键长之间)。
键级的分数值(如苯中C-C键键级为1.5)。
电荷的离域(部分正电荷δ⁺或部分负电荷δ⁻分布在多个原子上)。
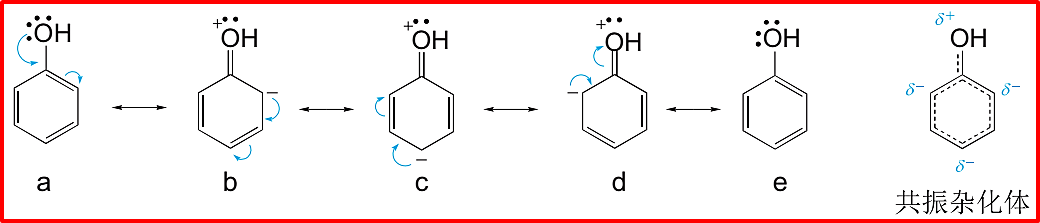
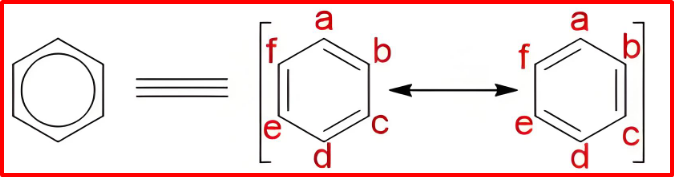
典例简析:苯(C₆H₆)
无法用单一的单双键交替六元环结构准确描述。实验表明苯是平面正六边形,所有C-C键长相等140pm,介于C-C单键154pm和C=C双键134pm之间。
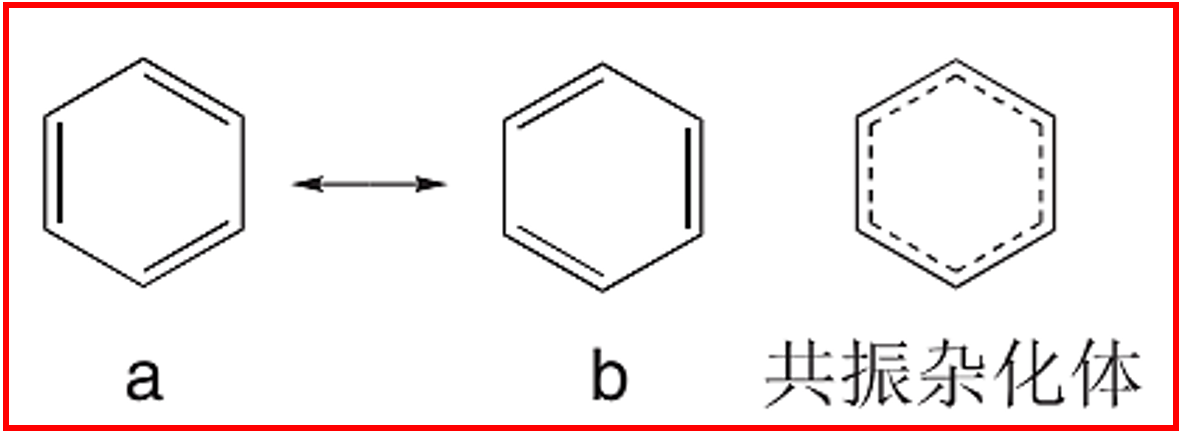
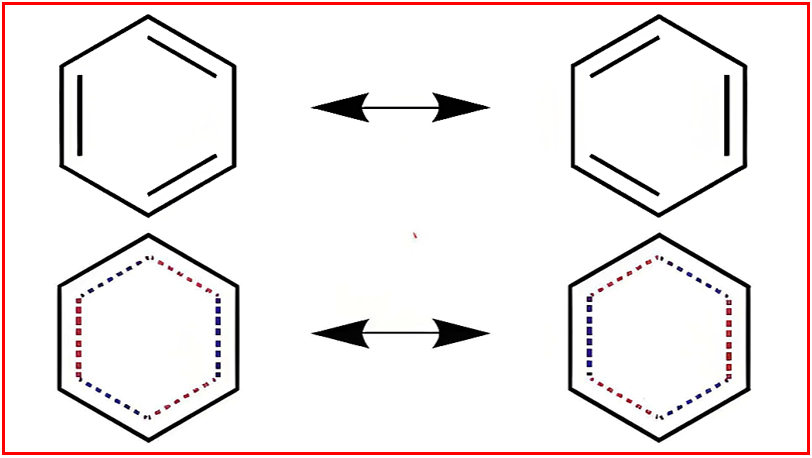
可以写出两个主要的共振结构(a和b),它们是单双键位置互换的凯库勒式。苯的真实结构是a和b的共振杂化体,贡献均等。常用正六边形内画一个圆圈⦿或虚线表示单双键平均化的键来表示杂化体。这种离域使苯具有特殊的稳定性,即共振稳定能。
三:共振结构的本质是什么?
共振现象的本质核心是电子的离域。σ键电子是定域的,不能离域。能离域参与共振的电子包括:π电子(双键、叁键)、孤对电子和未成对的单个电子,如自由基中。
离域要求:发生离域的轨道(如p轨道、π轨道)必须在空间上满足轨道方向性要求(平行或共平面),以实现有效重叠。
典例简析:p-π共轭
未杂化的p轨道(含电子或空轨道)与相邻π键的p轨道平行重叠(如烯丙基碳正离子、丙烯醛中的氧)。
如果轨道不平行,如sp³杂化的孤对电子轨道与垂直的p轨道,则无法有效离域,例如特定构象下的铵盐正离子或3-乙酰吡啶中氮的孤对电子与羰基π键。
四:如何书写共振结构?
书写共振式必须严格遵守以下规则:
①骨架不变:所有共振结构中的原子种类、连接顺序(分子骨架)和空间构型必须完全相同。仅电子(主要是离域电子)的排布方式不同。
②价键规则:第二周期元素(B,C,N,O,F)通常遵守八隅体规则(价电子层不超过8个电子),碳原子不能超过四价。
特例:第三、四周期元素(如S,P)可利用空的d轨道容纳更多电子,其价电子层可超过8个(如DMSO中S有10个价电子,磷酸酯中P有10个价电子)。
③净电荷相同:所有共振结构的总电荷数和电荷类型(如-1,0,+1)必须相同,电荷可以在不同原子间分布(电荷分离)。
④未成对电子数相同:对于自由基物种,所有共振结构中的未成对电子数目必须相同。
⑤电子离域的表示:使用弯箭头表示电子对的移动(↷),使用单钩箭头表示单个电子的移动(↶)。
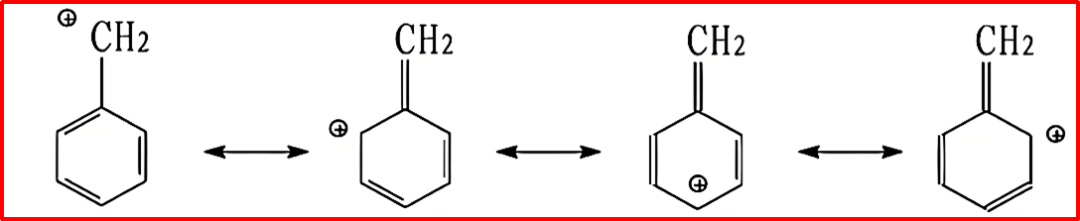
⑥电荷分离倾向:在电荷分离的共振结构中,π电子对倾向于向电负性更大的原子偏移,使该原子带部分负电荷(δ⁻),另一原子带部分正电荷(δ⁺)。例如丙酮C=O键,氧带δ⁻,碳带δ⁺。
如果双键、叁键两端原子电负性相同,电子向带正电荷的原子偏移,例如烯丙基碳正离子中,π电子流向缺电子的碳正中心。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
杂环化合物分为脂肪杂环和芳香杂环两类。分子骨架中的杂环不...
环氧乙烷又称氧杂环丙烷,是一个含氧的三元环,结构接近于等...
一 、醇的一些特殊化学性质 1 、醇的碱性:氧提供 共用电子对...
醚的物理性质: 在常温下除甲醚和甲乙醚为气体外,大多数醚为...
【导读】在化学中某些分子、离子或自由基无法用单一的路易斯...
1、羰基的亲核加成 (1)与含C亲核试剂的加成 RHO+R’MgX→无水醚...