
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
计算0.01mol ZnS溶于1.0L 盐酸中,所需盐酸的最低浓度?
查表可知:Ksp(Zns)=2.0×10-24; Ksp(CuS)=6.3×10-36; H2S:Ka1=1.3×10-24; Ka2=1.3×10-15
根据多重平衡规则可推算出总反应的平衡常数K为
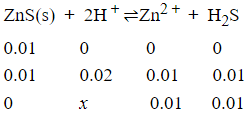
K=Ksp/(Ka1·Ka2)=(0.01)2/x2
x=0.21
故所需盐酸的最低浓度为0.23mol/L
同理:
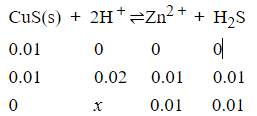
K=Ksp/(Ka1·Ka2) =(0.01)2/x2
所需盐酸的最低浓度为1.0×109mol/L.(这种浓度的盐酸根本不可能存在)

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
什么是“软硬酸碱理论”,1963 年,拉尔夫・皮尔逊提出软硬酸...
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...