
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
例1 已知下列物质在 20 ℃下的Ksp,见表 2。
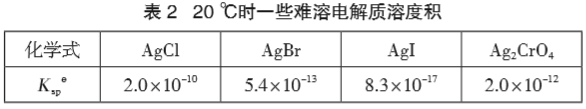
向含有浓度均为 0.01 mol·L-1 的 Cl-、Br -、I - 和 CrO42- 的溶液中,滴加 AgNO3 溶液,生成沉淀的先后顺序如何判断?
解 析:AgCl、AgBr、AgI 均 是 AB 型,它 们 的 溶 解度可由 Ksp 直接判断, Ksp : Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI), 则 溶 解 度 S : S (AgCl) > S (AgBr) > S (AgI), 即沉淀时,所需 Ag+ 最低浓度: c (AgCl) > c (AgBr) > c (AgI)。 Ag2CrO4 和 AgCl 不是同类型沉淀,且它们的溶度 积 Ksp 相差不大,沉淀所需Ag + 最低浓度必须计算出 来才能比较。 由 Ksp(AgCl)= c (Ag+)· c (Cl-) 得: c (Ag+)= ![]() mol·L -1=2.0×10-8 mol·L -1, 由 Ksp (Ag2CrO4)= c 2(Ag+)· c (CrO42-) 得: c (Ag+)=
mol·L -1=2.0×10-8 mol·L -1, 由 Ksp (Ag2CrO4)= c 2(Ag+)· c (CrO42-) 得: c (Ag+)= ![]() =1.4×10-5 mol·L -1。
=1.4×10-5 mol·L -1。
综上,沉淀所需Ag+ 最低浓度:Ag2CrO4>AgCl> AgBr>AgI,沉淀时所需的c(Ag+) 越小的,越容易沉淀, 故生成沉淀的先后顺序依次是:AgI>AgBr>AgCl>Ag2CrO4。
例2 已知Kspɵ(AgCl)=1.8×10-10, Kspɵ(AgBr)=5.0× 10-13, 现在向2.0 mol·L-1 KCl 和 0.0001 mol·L-1 KBr混 合液中滴加 0.01 mol·L-1 AgNO3 溶液,Cl -、Br - 谁先沉 淀?(设混合溶液在反应中体积不变)
解析:由 Kspɵ(AgCl)=c(Ag+)·c(Cl-) 得:
![]()
由 Kspɵ(AgBr)= c (Ag+)· c (Br-),得:
![]()
生成 AgCl 沉淀需c (Ag+)=9.0×10-11 mol·L -1 <生成 AgBr 沉淀时所需c (Ag+),故Cl - 先沉淀。
[结论] 混合溶液中几种离子与同一种沉淀剂反应生成沉淀的先后次序判断方法是:沉淀类型相同,被沉淀离子浓度相同时, Ksp小者先沉淀, Ksp大者后沉淀;沉淀类型不同或被沉淀离子浓度不同时,则要通过计算才能确定。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...