
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
将 AgCl 与AgBr 的饱和溶液等体积混合,再 加入足量浓 AgNO3 溶液,为什么 AgCl 和 AgBr 沉淀 都有,但以 AgCl 沉淀为主?
解析:
在 AgBr 的饱和溶液中 Ksp(AgBr)= 5.53×10-13, c (Br-)= c (Ag+)= 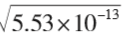 = 7.43×10-7 mol·L -1
= 7.43×10-7 mol·L -1
在AgCl的饱和溶液中 Ksp(AgCl)=1.77×10-10, c (Cl-) = c (Ag+)=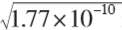 =1.33×10-5 mol·L -1
=1.33×10-5 mol·L -1
等体积混合后,
c (Ag+)=(7.43×10-7+1.33×10-5)/ 2 mol·L-1=7.02×10-6 mol·L -1
c (Cl-)=1.33×10-5/2 mol·L-1=6.65×10-6 mol·L -1
c (Br-) =7.43×10-7/2 mol·L-1=3.72×10-7 mol·L -1
此时, c (Ag+)· c (Cl-)=4.67×10-11 < Ksp (AgCl), c (Ag+)· c (Br-)=2.61×10-12 > Ksp(AgBr),即开始时AgBr 会沉淀, AgCl不会沉淀,但是再加入AgNO3 浓溶液, c (Ag+)增大, 当 c (Ag+)· c (Cl-)> Ksp(AgCl) 时,AgCl 也会沉淀;此题 加入的AgNO3 浓溶液是足量的,它将使溶液中的 Cl-、 Br- 尽可能都沉淀,由于 Cl - 明显比 Br- 多,因此 AgCl 沉淀就多于AgBr。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...