
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
键角即为多原子分子中,两个化学键的夹角。可以用来描述多原子分子的空间结构。其通过晶体x射线衍射实验来测定。键角的大小影响分子的许多性质,例如分子的极性,从而影响分子的溶解性,熔沸点等。
例如乙醛与二氧化碳的相对分子质量(M=44)相同,但标况下二氧化碳为气体,乙醛为液体。这是因为乙醛为极性分子,分子间作用力大。
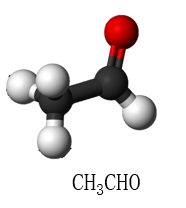
一、分子中心原子的杂化方式对键角有决定影响
价电子互斥理论认为,中心原子采用不同杂化方式时,其杂化轨道在空间处于不同的取向并尽可能远离。比较共价化合物分子的键角,首先就应当想到利用中心原子的杂化方式来判断。
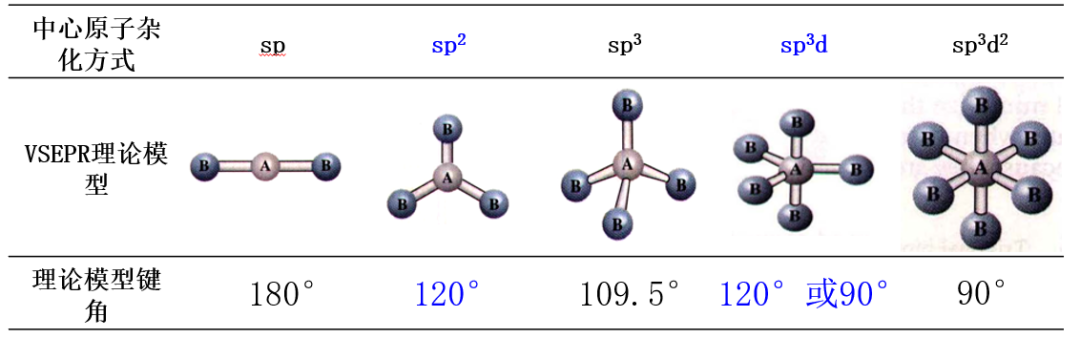
对于后两种配位数大于4的两种情况,需要考虑孤电子对的分布情况,弄清楚原子所处的空间位置,进而讨论夹角具体时由哪两个共价键所组成的。
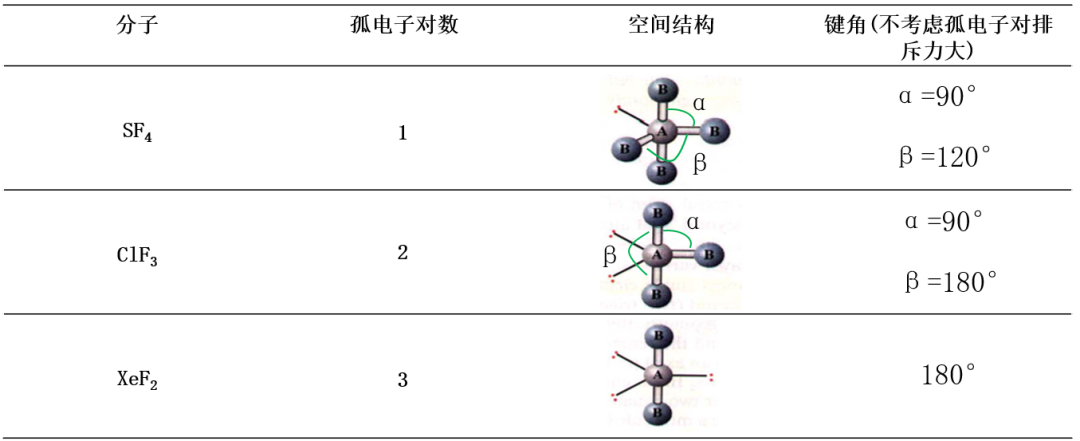
配位数为5的类型,孤电子对优先占据平面位置
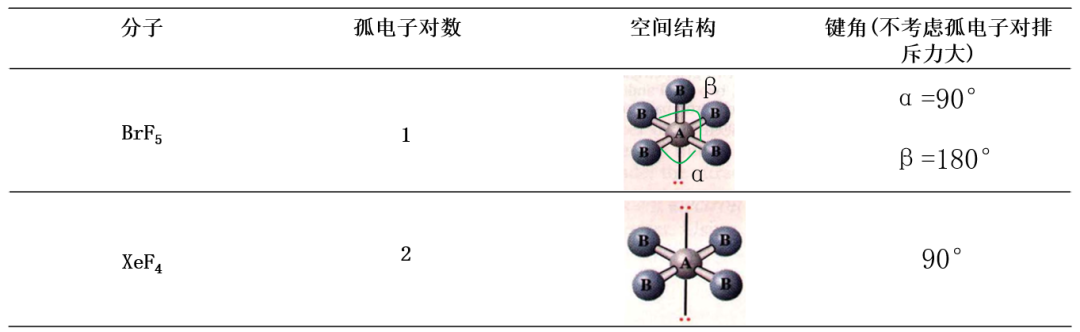
配位数为6的类型,孤电子对优先占据轴向位置
二、中心原子孤电子对数目对键角的影响
判断两个分子中键角大小时,如果中心原子杂化方式一致,则考虑孤电子对数目的影响。
价层电子对之间的斥力的大小有如下顺序:
l-l >> l-b > b-b (l为孤电子对对; b为键合电子对)
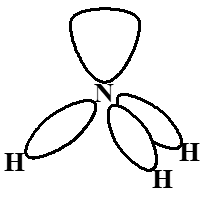
这一斥力顺序是最经常要考虑的。这是由于键合电子对受到左右两端带正电原子核的吸引,而孤电子对对只受到一端原子核吸引,相比之下,孤电子对的电子云较“胖”,占据较大空间,键合电子较“瘦”,占据较小的空间。
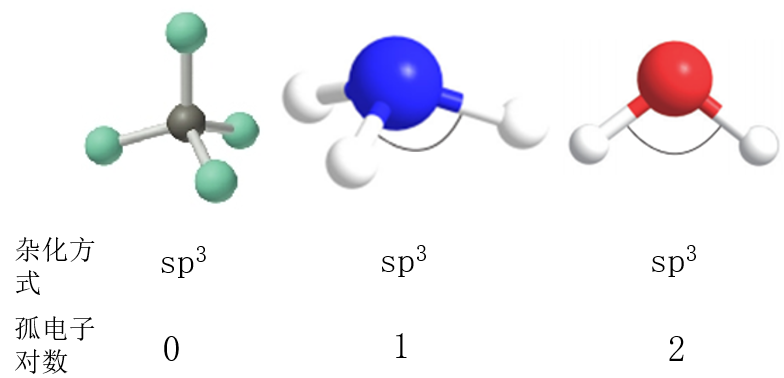
中心原子杂化方式相同,中心原子的孤电子对数越多,键角会变得越小。
三、配原子电负性对键角的影响
当中心原子种类相同(同一种原子)、杂化类型也相同,而配原子种类不同时,由于配原子的电负性不同,会使键角有区别。因为当相邻的两个成键电子对更靠近中心原子时、相互间的斥力会增大。反之,当相邻的两个成键电子对远离近中心原子时、相互间的斥力会变小。
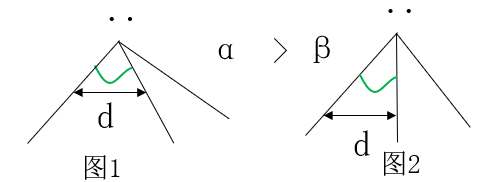
当两成键电子对的排斥距离差不多相当(都为D时)时,成键电子对距中心原子核距离近(图1)会造成键角变大。而成键电子对距中心原子核距离远(图2)会造成键角变小。
比较NH3和NF3键角的大小:
中心原子都是N原子、且都为sp3杂化,但因为F原子的电负性大于H原子,使成键电子离n(原子更远)(相当于图2),两个N-F键间的斥力减小、可以靠的更近,所以其键角更小。
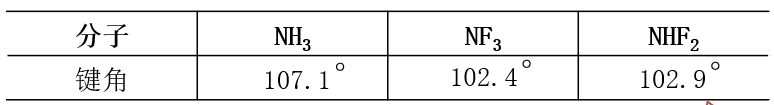
电负性大的配位原子数越多,成键电子对之间的排斥力越小,夹角会越小。
四、中心原子电负性对键角的影响
当中心原子种类不同(同主族),但杂化类型相同、且配原子种类相同时,中心原子的电负性大,成键电子对更靠近中心原子,成键电子对间的斥力要变大,键角要变大。反之,中心原子电负性小的分子,成键电子对要远离中心原子,成键电子对间的斥力要变小,键角要变小。
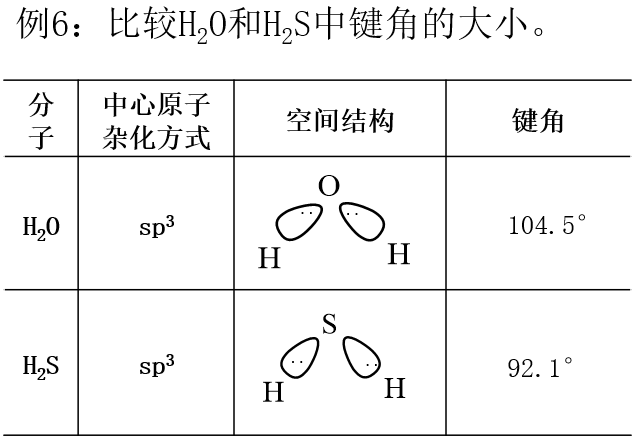
五、单键与多重键对键角的影响不同
当成键电子对中存在多重键时,由于多重键成键电子数目较多,导致多重键对单键成键电子对的排斥力要大一些,从而多重建与单键之间的角度大一些,单键与单键之间的键角小一些。
成键电子对斥力大小可以定性表示如下:
T-T > T-D > D-D > D-S > S-S (T-叁键, D-双键, S-单键)
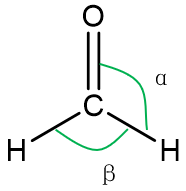
如图为甲醛分子结构式,试比较α与β的大小:
在HCHO分子中,C原子为sp2杂化。虽然等性sp2杂化的键角是120°。但由于C原子与O原子间以双键C=O结合,该双键对C-H键的斥力要更大些。所以α>β.
六、孤电子与孤电子对对键角影响不同
奇分子(有成单电子的分子)是很少遇到。奇分子的中心原子有一成单的孤电子,一般与组成和它基本相同、只是比它多一个或少一个电子的物种来比较,成单电子对成键电子的排斥力应该是小于孤电子对对成键电子对间的排斥力的。
比较分子中∠O-N-O键角大小

NO2中∠O-N-O键角大于理论值可能因为斥力:成键电子对-成键电子对>单电子-成键电子对.
七、配体体积对键角的影响
当配体基团的体积较大时,基团电子云占据的空间也会相应增大,对相邻的键也会有很强的排斥作用。
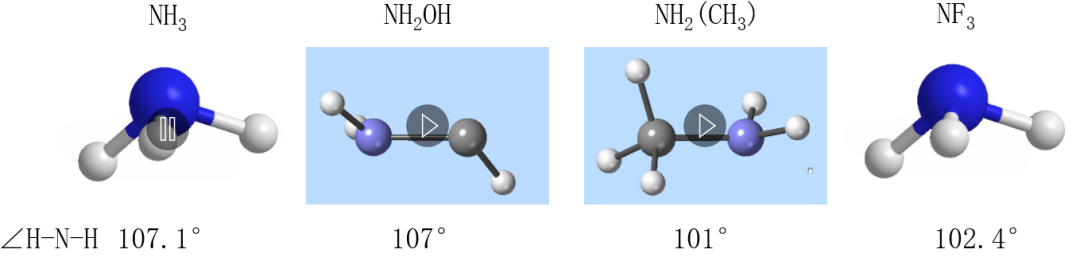
NH3、NH2OH、NH2(CH3),∠H-N-H键角依次减小。而对NF3与NH2(CH3),也是后者的∠F-N-F键角更小。这似乎说明体积更大些的CH3的排斥成键电子对的能力要强于OH,更强于H原子;CH3的排斥成键电子对的能力甚至于要强于F原子。
八、总结:
比较键角大小分析思路
从上面几方面的比较可以看出,这几个影响键角的因素都是有条件的,在影响键角的能力方面也是有区别的。在一般情况下,可以参照以下顺序来判断键角大小。
①先从中心原子的杂化类型来入手。因为杂化类型决定了分子的基本构型。
②在中心原子杂化类型相同的情况下,应从孤电子对的数目来考虑问题。
③在中心原子杂化类型相同,且孤电子对数目也相同时,再用中心原子或配原子的电负性不同来分析。
补充:在同一分子中,应考虑双键的影响。配体基团较大的情况不常遇到。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在晶体结构中,阳离子周围的阴离子总配位数,等于阴离子周围...
配位数之比(阳离子配位数:阴离子配位数)等于化学式角码反比...
一、金刚石结构 二、二氧化硅 三、氯化钠 插入投票 投票: 高...
第二页...
...
一、投影是什么? 从数学的角度来说,一般地,用光线照射物体...