
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
从三维空间角度认识晶体,是研究晶体结构的基础。根据《考试大纲》要求,金刚石、二氧化硅结构是教学的重点。以金刚石晶胞结构为例,金刚石晶体整体上是正四面体立体网状结构。每个碳原子L能层的4个电子采用sp3杂化,形成4个等同的杂化轨道,相邻的两个碳原子之间形成σ键。这样每个碳原子与周围4个碳原子形成4个σ键,每个碳原子都是直接相连的4个碳原子的重心。
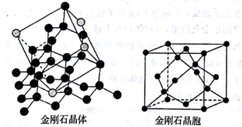
在一个金刚石晶胞中有8个碳原子位于立方体的顶点,6个碳原子位于面心,4个碳原子位于晶胞内部。每个晶胞中8个顶点中有4个顶点、6个面心和4个晶胞内部的碳原子形成4个正四面体,每个正四面体的4个顶点分别是一个晶胞顶点和这个顶点所在平面的面心,正四面体中心是晶胞内的1个碳原子。
用解析几何知识研究晶体中各个微粒间的位置关系更具体更直接。以底面一个顶点的碳原子(通常取后左下)为原点建立一个三维坐标系。
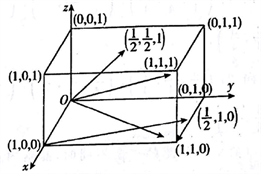
原点上的原子坐标为(0,0,0),晶胞边长参数看作1,并据此分析坐标参数。在晶胞进行“无隙并置”时,可以看出,8个顶点的原子都可以作为原点,注意看清楚,与这个原点原子重合的是晶胞上哪一个顶点的碳原子。所以顶点上的8个原子坐标都是(0,0,0),这与纯粹立体几何不同,所以高中阶段我们只标注顶点以外的晶胞内和晶胞上点的坐标;棱心和面心坐标点中数据中不会出现“1”。
以下是晶胞中各点对应的坐标。
6个面心坐标
上面心 | 下面心 | 左面心 | 右面心 | 前面心 | 后面心 | |
三维坐标 |
|
|
|
|
|
|
晶体中坐标 |
|
|
| |||
12个棱中心坐标
上面四条棱 | ||||
三维坐标 |
|
|
|
|
晶体中坐标 |
|
| ||
下面四条棱 | ||||
三维坐标 |
|
|
|
|
晶体中坐标 |
|
| ||
垂直底面四条棱 | ||||
三维坐标 |
|
|
|
|
晶体中坐标 |
| |||
金刚石晶胞有两种取向,由于金刚石晶胞内部有4个碳原子,在空间分布是不对称的,所以从不同方向观察晶胞时,内部的4个碳原子的位置是不相同的。我们把左边的图叫作取向1,右边的图叫作取向2
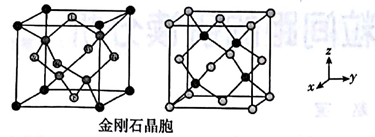
它们各自绕竖直中心轴旋转90°,就能够变为对方。金刚石晶胞内4个碳原子坐标:
取向1: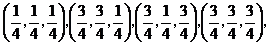
取向2:![]()
所以金刚石晶胞的取向不同时,晶胞内部不对称的4个原子的坐标会发生改变。
下面以两道高考题为例分析
【例1】晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为________。
,0)。则D原子的坐标参数为________。![]()
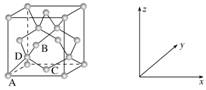
【例2】一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
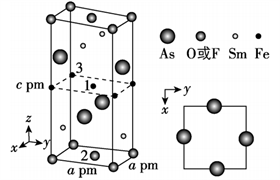
图1 图2
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
【答案】根据原子1的坐标(![]() ,
,![]() ,
,![]() ),可知原子2和3的坐标分别为(
),可知原子2和3的坐标分别为(![]() ,
,![]() ,0),(0,0,
,0),(0,0,![]() ),
),
【拓展】高考考纲明确要求掌握SiO2晶体结构,单晶硅和金刚石结构完全相同,SiO2晶体相当于在每个Si-Si键中间插入1个O原子。下面是我们常见的几种SiO2晶体空间构型:
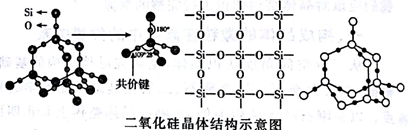
实际上,每个硅原子M能层的4个电子采用sp3杂化形成4个等同的杂化轨道,与相邻的两个氧原子之间形成键。这样每个硅原子与周围4个氧原子形成4个σ键,每个硅原子都是与其直接相连的4个氧原子的重心。但每个氧原子连接2个硅原子,氧原子也是采用sp3杂化,形成4个等同的杂化轨道,与相邻的两个硅原子之间形成2个σ键,氧原子的占据杂化轨道的两对孤电子对对硅氧原子间的2个键有排斥作用,所以SiO2晶体中Si-Si键角小于180°,常见的SiO2晶体结构示意图明显存在错误。真实的SiO2晶胞见下图。
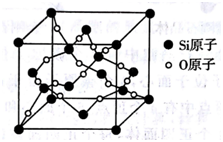
SiO2晶胞中Si原子坐标与金刚石完全相同,但高中阶段无法标注氧原子坐标。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
在晶体结构中,阳离子周围的阴离子总配位数,等于阴离子周围的阳离子总配位数。我们称...
一、投影是什么? 从数学的角度来说,一般地,用光线照射物体,在某个平面上得到的影...
金刚石晶胞中的原子排列方式图进行计算。 ①空间占用率的计算: 图中的原子数目计算:...
微粒间距离的计算常常涉及晶体密度、 N A 、 M 、晶体体积等数据,解答这类题目时,一...
晶胞投影问题是 《 物质结构与性质 》 这一 部分的重点和难点 , 在高考中考查起点高...