
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
微粒间距离的计算常常涉及晶体密度、NA、m、晶体体积等数据,解答这类题目时,一要掌握“均摊法”原理,二要熟悉常见晶体的结构特征,三要明确微粒的位置,结合数学知识,找出所求微粒间的距离与晶胞边长、面对角线或者体对角线的关系。结合晶体密度、NA、m、晶体体积等数据的运算,能融会贯通,举一反三。
对于晶胞的有关计算,考查的是学生运用化学用语及文字、图表、模型、图形分析和解决化学问题的能力,借助离子、分子晶体模型解释化学现象,揭示现象本质和规律,需要同学们熟悉掌握金刚石晶胞结构。
对于能力方面的考查,侧重于理解与辨析、分析与推测、归纳与论证能力。一是通过图形阅读获取初步印象,并进行加工、吸收;二是从提供的新知识中,准确地提取实质性内容,并与已有知识结合、重组为新知识块。
典例剖析
[例1][2019·全国卷Ⅰ,35]在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________pm,Mg原子之间最短距离y=__________pm。
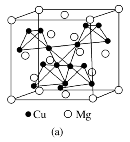
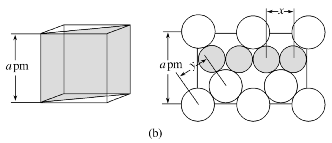
解析:
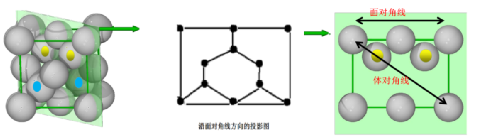

[例2]由Al元素和N元素形成的某种化合物的晶胞如图所示,已知N原子位于晶胞体对角线的1/4处。假设该化合物晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,则晶胞中相距最近的两个N原子之间的距离为( )
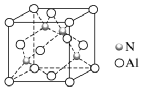

解析:解决本题应熟悉晶胞结构,用均摊法计算确定化学式侧重于理解与辨析、分析与推测能力的考查。一是通过图形阅读获取初步印象,并进行加工、吸收;二是通过晶胞结构计算原子间距离。将题图中立方体顶面上的4个顶点从左上角小球开始按逆时针方向依次标为1、2、3、4,将立方体的体心和1、3号小球连接起来,则形成1个等腰三角形,晶胞中相距最近的两个N原子之间的距离即为该等腰三角形的中位线的长度,故两个相距最近的N原子之间的距离等于晶胞面对角线的一半。根据晶胞结构可知,1个晶胞中含有4个N原子、4个Al原子,设晶胞边长为a cm,则晶体的密度

答案:A
【名师点拨】
1.先确定微粒的位置,结合数学知识确定所求微粒间的距离与晶胞边长、面对角线或者体对角线的关系,进而求出距离。
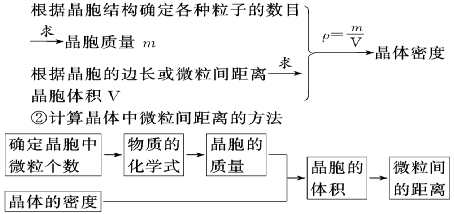
2.①计算晶体密度的方法
演练体验
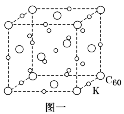
1.(1)碳的一种单质C60可以与钾形成低温超导化合物,晶体结构如图一所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为______________;其晶胞参数为1.4 nm,晶体密度为______________ g·cm-3(列式并计算保留1位小数)。
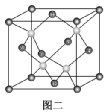
(2)已知金刚石的晶胞如图二所示,若该晶体的密度为a g·cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个C原子之间的距离为________ cm(用代数式表示,不必化简)。
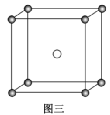
(3)固态PCl5结构中存在PCl4+和PCl6-两种离子,其晶胞如图三所示。
已知晶胞的边长为a nm,阿伏加德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为________ pm,固态PCl5的密度为________ g·cm-3。
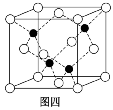
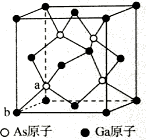
(4)砷化镓的晶胞结构如图四所示,若该晶体密度为ρ g·cm-3,设阿伏加德罗常数的值为NA,则晶胞参数为________(已知Ga的相对原子质量为70,As的相对原子质量为75)。
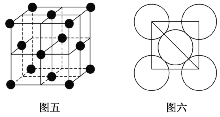
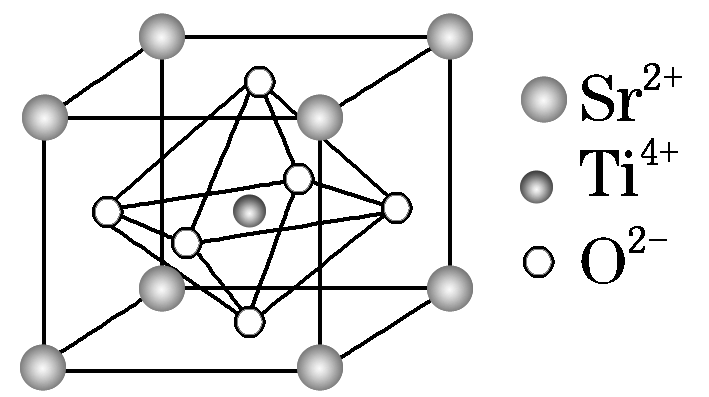
(5)Al单质的晶胞特征如图五所示,原子之间相互位置关系的平面图如图六所示。若已知Al原子的半径为A,NA代表阿伏加德罗常数的值,Al的相对原子质量为M,则一个晶胞中Al原子的数目为________;Al晶体的密度为________________。
(6)钛酸锶的晶胞结构如图所示。钛酸锶的摩尔质量为Mg·mol-1,密度为x g·cm-3,NA代表阿伏加德罗常数的值,在SrTiO3晶胞中2个氧离子之间的最短距离为________ nm。
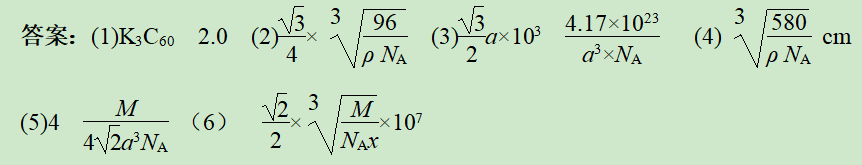
2.N、P、As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为__________,N-N键的键角为__________。
(2)基态砷原子的价电子排布图为__________,砷与同周期相邻元素的第一电离能由大到小的顺序为__________。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是__________(填"PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是__________。S-Cl键键长______P-Cl键键长(填“>”、“=”或“<”),原因是__________。
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为__________。若该晶体的密度为ρ g•cm-3,设Na为阿伏加德罗常数的值,则a、b的距离为__________pm(用含ρ和NA的代数式表示)。
答案:
(1)sp3 60℃
(2)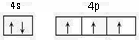 As>Se>Ge
As>Se>Ge
(3)PH3
(4)三角锥形 < S原子半径小于P原子半径故S-Cl键要比P-Cl键短
(5)GaAs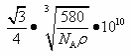
3.据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)TE属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态Na原子中,核外电子占据的原子轨道总数为______,最高能层电子云轮廓图形状为______。
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为______ (用元素符号表示)。
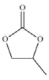
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为______,1mol 碳酸丙烯酯中σ键的数目为______。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是______,该配离子包含的作用力为______ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)氮化铁晶体的晶胞结构如图1所示,该晶体中铁、氮的微粒个数之比为______。
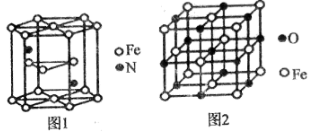
(7)已知:氧化亚铁晶体的密度为p g•cm-3,NA表示阿伏加德罗常数的值。氧化亚铁晶体的晶胞如图2所示,该晶胞中,与O2-紧邻且等距离的O2-数目为______;Fe2+与O2-的最短核间距为______pm。
答案:
(1)P 5s25p4
(2)6 球形
(3)O>Cl>C
(4)平面三角形 sp2、sp3 13NA
(5)H2O C
(6)3:1
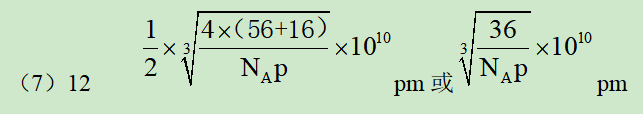

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。第二页...
...
在晶体结构中,阳离子周围的阴离子总配位数,等于阴离子周围的阳离子总配位数。我们称...
一、投影是什么? 从数学的角度来说,一般地,用光线照射物体,在某个平面上得到的影...
金刚石晶胞中的原子排列方式图进行计算。 ①空间占用率的计算: 图中的原子数目计算:...
微粒间距离的计算常常涉及晶体密度、 N A 、 M 、晶体体积等数据,解答这类题目时,一...