
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在晶体结构中,阳离子周围的阴离子总配位数,等于阴离子周围的阳离子总配位数。我们称这个规律为配位数守恒关系。
这是化学奥林匹克竞赛才会用到的知识点,但它非常容易理解,值得各学段范围的同志们学习。在没有图、复杂图、或看不清图的情况下,这个规则往往会有奇效。
先举两个简单的例子:
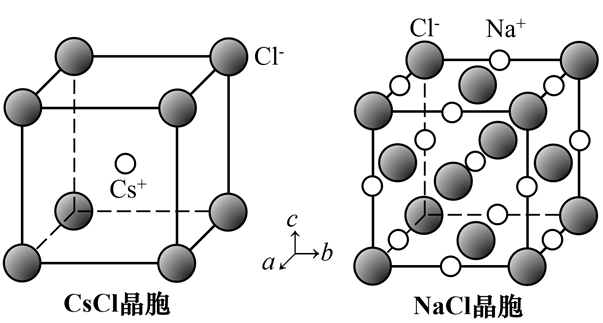
①CsCl晶体中,Cs+周围有8个最近的Cl-,而Cl-周围也有8个最近的Cs+。
②NaCl晶体中Na+周围的Cl-配位数为6,Cl-周围的Na+配位数也为6;
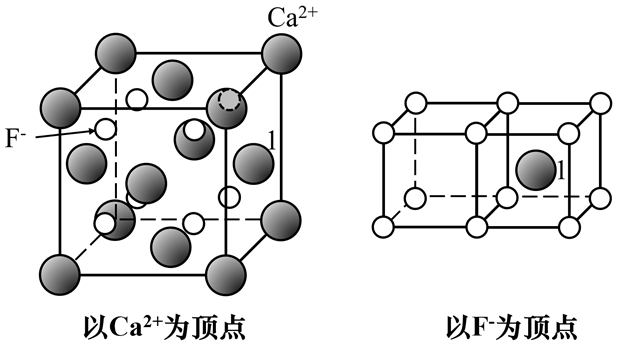
CaF2晶体中,Ca2+位于F-形成的立方体空隙中,配位数为8;F-位于Ca2+形成的四面体空隙中,配位数为4。由于晶体中Ca2+与F-的比例为1:2,满足4×2 = 8×1。
CaTiO3晶体中,Ca2+周围的O2-配位数为12,Ti4+周围的O2-配位数为6,O2-周围的阳离子(Ca2+和Ti4+)配位数为6。满足12×1 + 6×1 = 6×3。
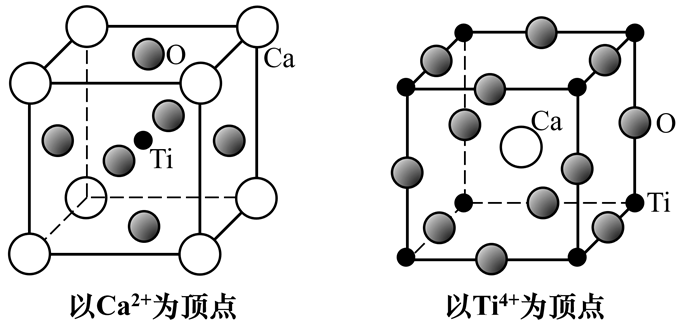
非常重要的是,O2-周围的阳离子(Ca2+和Ti4+)配位数是可以通过纯计算算出来的:(12×1 + 6×1)÷3 = 6。这就为没有图、复杂图、或看不清图的题目留下了操作空间。让我们看几个例子:
例1(2021年初赛):CaO3中,Ca2+位于端基氧原子形成的立方体空隙中,写出阴离子端基氧的化学环境。(注:O32-为折线形)
解析:O32-中有1个中间氧,2个端基氧。结合配位数守恒关系,2个端基氧周围的Ca2+配位数的总数,等于Ca2+周围端基氧的配位数。Ca2+位于端基氧原子形成的立方体空隙中,其配位数为8,故端基氧周围的Ca2+配位数为4。
解答:端基氧周围有1个氧原子(中间氧),4个Ca2+
例2(2019年初赛节选):某镧系元素(用RE表示)配合物可表示为[Re6(OC3H7)17]Cl。内界离子中,所有Re化学位置完全相同,每个Re周围有5个O原子。所有OC3H7(异丙醇阴离子)中的O原子均参与配位,且有3种类型(端基、边桥基、面桥基)。请问这三种类型氧原子的数目分别是多少?
解答:在配合物等有限结构中,也要遵循配位数守恒关系。设O原子端基(μ1)、边桥基(μ2)、面桥基(μ3)的数目分别为n1、n2、n3,我们可列出两个方程:n1 + n2 + n3 = 17、n1 + 2n2 + 3n3 = 5×6。所有RE化学位置完全相同,端基O原子数只能是6的倍数(6或12)。由于n2、n3只能取大于0的整数,我们只能获得一组解:n1 = 6、n2 = 9、n3 = 2。
例3:下图为某晶体沿a轴(左)、c轴(右)方向投影图,其中大球是Zn,小球是N,请写出该晶体的化学式。
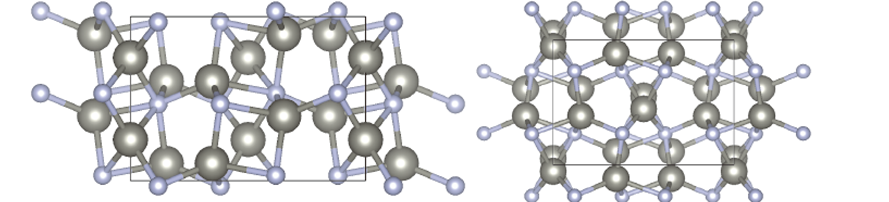
解答:这个晶体的结构过于复杂,完全无法辨认各原子在晶体中的位置,以至于无法通过均摊法计算晶胞中原子的具体数量。
我们观察到,每个Zn原子周围有4个N原子,每个N原子周围有6个Zn原子。结合配位数守恒关系,可得Zn与N的比例为3:2,即3×4 = 2×6。故晶体的化学式为Zn3N2。该结论符合Zn、N的常见化合价。
例4(2019年北京预赛节选):下图为超高压条件下FeN4晶体的晶胞结构示意图,请指出Fe(大球)、N(小球)原子的配位数。
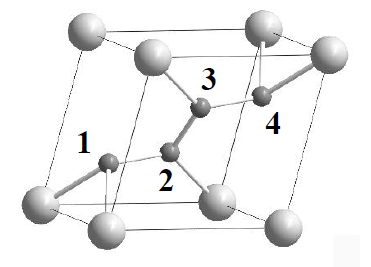
解答:N原子周围的Fe原子数很容易看出来,其中1号、4号是2配位,2号、3号是1配位。然而Fe原子周围的N原子数无法简单地看出来。此时我们要是用配位数守恒关系,Fe周围N原子数为1×2 + 2×2 = 6。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在晶体结构中,阳离子周围的阴离子总配位数,等于阴离子周围...
配位数之比(阳离子配位数:阴离子配位数)等于化学式角码反比...
一、金刚石结构 二、二氧化硅 三、氯化钠 插入投票 投票: 高...
第二页...
...
一、投影是什么? 从数学的角度来说,一般地,用光线照射物体...