
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、核外电子运动状态的描述
描述核外电子运动状态的数学表达式:薛定谔方程(波动方程)。
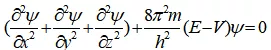
( x、y、z)为电子位置坐标,m为电子质量,h、π为常数,E为电子总能量,V为核对电子的吸引即势能;Ψ体现波动性的物理量。
1、波粒二象性:
波函数Ψ(x,y,z),反映了电子的波动性;m,E,V,等反映了电子的粒子性。
波函数Ψ:描述核外电子在空间运动状态的数学函数式。原子轨道是指电子的一种空间运动状态,二者是同义语。
波动方程理解:对于一个质量为m,在势能V的势能场中运动的电子,其波动性可以由波函数Ψ描述,该方程的每一个特定解Ψ(x,y,z)表示原子中电子运动的某一稳定状态。
求解波动方程过程中,引入了三个参数(n、l、m),只有当(n、l、m)合理取值时,方程才有合理Ψ(x,y,z)解,可用来描述核外电子的运动状态。三个参数(n、l、m)被称为量子数。薛定谔方程的解是包含n、l、m三个参数项的三变量(x,y,z)的函数,可表示为
Ψ(x,y,z)→Ψ(n,l,m)(x,y,z)
三个量子数对应一个特定的波函数,即三个量子数可以描述电子的空间运动状态即原子轨道。
每一个由一组量子数所确定的波函数Ψ(n,l,m)表示一种电子的运动状态,如果确定核外电子的运动状态还需要一个描述电子自旋特征的量子数ms。
2、量子数:
(1)主量子数(n):
描述原子中电子出现几率最大区域离核的远近,或者说它决定电子层数。
取值为 n = 1、2、3……
当n =1时,电子出现区域离核最近,即第一电子层,能量最低;n越大,电子出现区域离核的平均距离越远,能量逐渐升高。
(2) 副量子数(l)(亦称角量子数):
描述原子轨道或电子云的不同形状。
l的取值:0、1、2……(n–1),共n个取值。
l的取值受主量子数n的限制。
每一个l值表示一类原子轨道的形状。
主量子数(n)表示电子层,副量子数(l)则可以说表示同一电子层中具有不同状态的亚层。
如:n =3,则l =0 、1、2。
(3) 磁量子数(m):
描述原子轨道在空间的伸展方向。
m取值:0、±1、±2、…… ±l,共有(2 l +1)个取值。
l=0时,m = 0,即s 轨道只有一种空间取向。
l=1时,m = +1 、0、-1,p 轨道有三种空间取向(px、py、pz)。
l=2时,m = +2 、+1 、0、-1、-2 ,d 轨道有五种空间取向。
注意:空间取向不同,并不影响电子的能量,即相同的几个原子轨道的能量是相同的。
n、 l 、m各自的数值一定,波函数的函数式随之而确定,也就确定了原子轨道,包括轨道的远近、形状和空间取向。
(4) 自旋量子数ms
电子自旋有两个相反的方向,自旋量子数只有两个值,即ms =+1/2 、-1/2 。
由上所述:由四个量子数可以确定电子在原子核外的运动状态。
二、电子的能量,原子轨道与运动状态的描述
多电子原子中电子的能量决定于主量子数n和副量子数l 。
一个原子轨道可由n,l,m 这3个量子数确定。
一个电子的运动状态必须用n,l,m,ms 这4个量子数描述。
注意:空间取向不同,并不影响电子的能量,即相同的几个原子轨道的能量是相同的。
n、 l 、m各自的数值一定,波函数的函数式随之而确定,也就确定了原子轨道,包括轨道的远近、形状和空间取向。
n:决定原子轨道或者电子云的大小;
l:决定原子轨道或者电子云的形状
m:决定原子轨道或者电子云的伸展方向 。
ms:电子自旋。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。为什么元素周期表第8族不归到主族或副族中?是为了与7个主族对应,列了7个副族.另外,第...
副族和Ⅷ族有什么区别? 是的,旧版教材Ⅷ族不属于副族: 2004年初审通过:人教版《高...
...
1895年首先由德国物理学家伦琴所发现。这种射线是不可见的,但能使底片感光。由于当时...
在科学昌盛的20世纪,利用人工方法把一种化学元素转变为另一种元素并不是不可能的。这...
以ⅢB族镧为首的一系列元素叫镧系元素。它包括从原子序数57到71共15种元素。这15种元...