
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、NH3是否具有氣化性?
我们在学习NH3的化学性质时,主要讲它具有碱性和还原性,那么氨是否具有氧化性呢?
当然有,从氧化还原的概念出发看,一切化合物都应该既具有氧化性,也具有还原性,因为凡是化合物, 必然含有正价元素与负价元素,而任何元素都具有0 价态(单质),由正价变0价则会获得电子,显示氧化性,由负价变0价则会失去电子,显示还原性。不管得、 失电子多么困难,理论上总是有此可能性的,但是学习过程中会发现这样的反应不一定能发生,比如 CO2,理论上其中一2价的氧元素具有还原性,但我们 没有看到过CO2被氧化为O2的实例。NH3则不然,液氨中溶解了金属钠后,微热过程中可以放出H2,可 认为NH3把金属钠氧化了:2Na+2NH3=2NaNH2 + H2↑。从这点上看,NH3与H2O是相似的,但是NH3 比水更难电离出H+,氧化性也更弱一些。
2、为什么做浓盐酸与浓氨水作用形成白烟的实验时,总是看到白烟出现在离盐酸近的一侧?
能够观察到这样的现象说明观察者非常认真、仔细,如果实验时室内空气流动性大,则不一定能够确认白烟出现在离盐酸近的 一侧,只有在无风的状态下做该实验时,才能够观察到上述现象,这与气体的扩散速率不同有关。大量的白烟出现在靠近盐酸试剂瓶的一方, 说明NH3的扩散速率比HCl快。
1828年,英国科学家格雷姆通过实验总结出了气体扩散定律:在一定温度和一定压强下气体通过小孔向真空扩散或通过多孔壁扩散的速率和其密度或摩尔质量的平方根成反比,即:
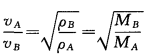
通过该定律,可以算出NH3与HCl的扩散速率 之比为:
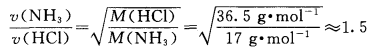
NH3分子和HCl分子在扩散过程中,会与空气 中的气体分子发生碰撞,因此,我们观察到的扩散速率只是NH3分子与HCl分子二者的相对比较。
3、氨水并没有酸性,为什么铜丝插入氨水中溶液会很快变蓝色?
通常情况下,铜被空气中的O2或水溶液中溶解的O2氧化的速率很慢,以至于我们短时间内很难觉察到暴露在空气中的铜丝或者泡在水中的铜片表面会发生什么变化,但是铜与O2的反应是自发倾向很大的反应。当把铜丝浸泡在氨水里时,溶液中溶解的O2把Cu氧化成Cu2+后,Cu2+随即与NH3分子发生配位化学反应,转化为[Cu(NH3)4]2+,使得游离的 Cu2+浓度迅速降低,促使上述氧化反应不断发生,总的反应式可以写作:
2Cu+O2 +8NH3 +2H2O=2[Cu(NH3)4]2+ +4OH-
产物[Cu(NH3)4]2+具有深蓝色,故若把铜丝插 入氨水中,氨水会很快变为蓝色,铜丝被腐蚀。
4、NH3和H2O分子间氢键如何形成?
氨水中,NH3与H2O分子中的各个原子都符合形成氢键的条件,那么理论上分析,NH3与H2O之间 可以形成如下2类不同的氢键:
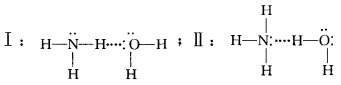
这2种氢键以哪种为主呢?根据氢键的形成条件,从理论上分析:形成氢键的一方应该有1个几乎 “裸露”的质子(氢原子),也就是说,这个氢原子的正电性越强就越有利于氢键的形成,显然H2O中氢原 子的电子云受到电负性大的氧原子吸引,要比NH3 中的氢原子“裸露”得彻底一些;而形成氢键的另一方 要能够给出电子对,氮原子与氧原子相比,氮的电负性要小一些,它更容易给出电子对(尽管它只有1对孤对电子),从NH3具有碱性而H2O为中性可知, NH3中的氮更易给出电子对,由此不难判断NH3、 H2O分子间的氢键应该以上述II式为主。
从实验事实的角度审视:NH3·H2O可以微弱电离为NH4+与OH-,用II式结构可示意如下:
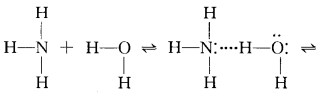
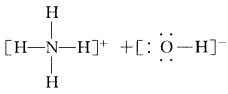
NH3·H2O中氢键上的H原子在N和O原子间来回“摆动”的过程中,某一瞬间与N原子结合得更紧密,于是“跟随NH3而去”,变为具有四面体结构的 NH4+,原来的H2O则因失去H+而变为OH-,这正 是NH3·H2O电离的微观过程,而用I式是难以对 NH3·H2O的电离做出合理解释的。
当然,就结合质子(H+)的能力而言,OH-要比 NH3强得多,故NH3·H2O只可能有极少的分子发生电离作用(常温下0.1 mol·L-1的氨水中,只能电离 约 1.3%)。
5、关于氨气实验室制法的一些问题
a)实验室里,为什么一般选择Ca(OH)2与 NH4Cl反应制备氨气而不是其他铵盐或碱?
首先,在常见的所有碱中,Ca(OH)2最便宜,在 常见铵盐中,NH4Cl最便宜,虽然实验室制法中不太需要考虑原料的价格,但在安全性、原料价格等方面相当的条件下,有便宜的还是不去用贵的。其次,该反 应为固体间的反应,考虑反应速率,需要把固体研磨成粉末状,故一般不用NaOH,因为它在研磨过程中非常容易吸水变成黏稠的糊状。
当没有NH4Cl时,可以用(NH4)2SO4替代,但 一般不用NH4NO3,因为NH4NO3本身属于炸药,操作不当时(受热或受到撞击)容易爆炸。
b)为什么不可用无水氯化钙干燥NH3?如果说 氯化钙会吸收氨气,那么制取氨反应的产物中不也有氯化钙吗?
常温下,有如下反应:CaCl2 +8NH3 =CaCl2 • 8NH3,故不宜用中性干燥剂CaCl2干燥.该反应与 CuSO4和H2O结合的反应类似,属于配位化学反应, 但加热时,CaCl2·8NH3不稳定,会分解为CaCl2和 NH3。这又与浓硫酸常温下吸收乙烯气体(不可用浓 硫酸干燥,反应为:CH2=CH2 + H-OSO3H(浓)→ CH3CH2-OSO3H(硫酸氢乙酯)),但170 °C下却可 以用浓硫酸制取乙烯的道理非常相似。
c)收集氨气时,试管口处为什么要塞一团棉花?
这团棉花起到“节流”的作用,它的存在,使得试管口处气体对流(里面的空气、氨气向外排放的同时,外面的空气也会向试管内扩散,在管口处形成涡流)速度减缓,这样随着NH3的通入,里面的气体慢慢向外 排出,有利于收集到浓度较大的NH3。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
磷作为周期表第 ⅤA 族核心元素,兼具 “生命不可替代性”(构...
硫酸盐 俗名 颜色 用途 2CaSO 4 H 2 O 熟石膏 白色 CaSO 4 2H 2 O 生石膏...
...
1.在二元化合物中,如果电正性的金属元素仅出现两种氧化态时...
合金的熔点一定低于各成分金属吗?教材只是说合金的硬度、熔...
金属锌与硝酸的反应,是一个非常经典的化学反应问题。金属锌...