
|
学习小专题 |

|
学习小专题 |
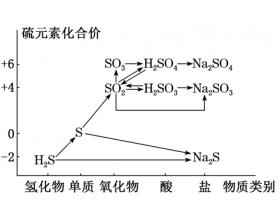 [导学与精要9] 硫、氮价类二维图 作者:化学自习室 来源:未知 日期:2023-10-07 15:08:41 点击:5152 所属专题:硫及其化合物 氮及其化合物
[导学与精要9] 硫、氮价类二维图 作者:化学自习室 来源:未知 日期:2023-10-07 15:08:41 点击:5152 所属专题:硫及其化合物 氮及其化合物
硫元素的价类二维图 硫及其化合物的相互转化 氮元素的价类二维图...
 [导学与精要9] 二氧化硫三大实验考点总结 作者:化学自习室 来源:未知 日期:2023-08-14 09:55:11 点击:2541 所属专题:二氧化硫
[导学与精要9] 二氧化硫三大实验考点总结 作者:化学自习室 来源:未知 日期:2023-08-14 09:55:11 点击:2541 所属专题:二氧化硫
一、二氧化硫的实验室制备 1 、实验原理: 2 、实验装置 : (1)发生装置: ①用分液漏斗、圆底烧瓶组装的固液加热型制气装置 ②铜( 可抽动铜丝,可随时控制反应发生和停止 )与浓硫酸加热 (2)净化装置:盛有浓硫酸的试管,干燥除水蒸气 (3)收集方法: 向上排空气...
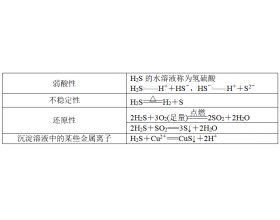 [导学与精要9] 硫的化合物性质知识点总结 作者:化学自习室 来源:未知 日期:2023-08-13 16:47:36 点击:3718 所属专题:硫及其化合物
[导学与精要9] 硫的化合物性质知识点总结 作者:化学自习室 来源:未知 日期:2023-08-13 16:47:36 点击:3718 所属专题:硫及其化合物
一、硫化氢 1、物理性质 H2S是一种具有臭鸡蛋气味的气体,ρH2S>ρ空气,能溶于水。 2、化学性质 3、实验室制取方法: FeS+H2SO4===FeSO4+H2S↑。 二、浓硫酸的性质与应用 1、硫酸的结构 (1)S原子杂化方式:sp3杂化 (2)化学键:含2个配位键,提供孤对电子的是硫...
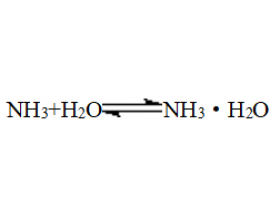 [导学与精要9] 氮及其化合物性质知识点总结 作者:化学自习室 来源:未知 日期:2023-08-13 19:58:10 点击:4163 所属专题:氮及其化合物
[导学与精要9] 氮及其化合物性质知识点总结 作者:化学自习室 来源:未知 日期:2023-08-13 19:58:10 点击:4163 所属专题:氮及其化合物
一、氨气的性质 1、物理性质 (1)色味态:无色、有刺激性气味的气体 (2)密度:比空气的小 (3)溶解性:极易溶于水,1∶700,难溶于CCl4 (4)物理特性:易液化(沸点-33.5℃) 2、碱性气体 (1)水: (2)指示剂:能够使紫色石蕊试液变蓝,酚酞试液变红 (3)与酸...
 [导学与精要9] 晨读笔记:氮及其化合物 作者:化学自习室 来源:未知 日期:2023-08-09 20:01:12 点击:2427 所属专题:氮及其化合物
[导学与精要9] 晨读笔记:氮及其化合物 作者:化学自习室 来源:未知 日期:2023-08-09 20:01:12 点击:2427 所属专题:氮及其化合物
一、 n (的结构与)N 2 01. n (元素位于元素周期表的第二周期)、第V a 族。 02.氮原子的最外电子层有5个电子,既不容易得到3个电子,也不容易失去5个电子。因此,氮原子一般通过共用电子对与其他原子相互结合构成具体物质,如NH 3 、NO、NO 2 、HNO 3 等。 03.氮元素...
 [导学与精要9] 晨读笔记:硫及其化合物 作者:化学自习室 来源:未知 日期:2023-08-09 19:53:59 点击:1610 所属专题:硫及其化合物
[导学与精要9] 晨读笔记:硫及其化合物 作者:化学自习室 来源:未知 日期:2023-08-09 19:53:59 点击:1610 所属专题:硫及其化合物
01.硫元素在自然界中既有游离态,也有化合态。 02.游离态的硫主要存在于火山喷发口,而化合态主要以硫化物、硫酸盐的形式存在。 如硫铁矿(FeS 2 )、黄铜矿(CuFeS 2 )等,石膏(CaSO 4 ·2H 2 O)、芒硝(Na 2 SO 4 ·10H 2 O)等。 03.硫是淡黄色固体,难溶于水,微溶于酒精...
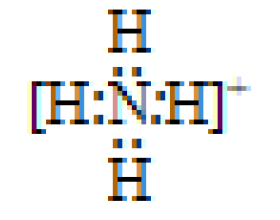 [导学与精要9] 晨读笔记:化学键 作者:化学自习室 来源:未知 日期:2023-08-09 16:49:10 点击:613 所属专题:化学键
[导学与精要9] 晨读笔记:化学键 作者:化学自习室 来源:未知 日期:2023-08-09 16:49:10 点击:613 所属专题:化学键
01.相邻微粒间的强烈相互作用称为化学键。 02.阴阳离子通过静电作用形成离子键,静电作用包含静电引力和静电斥力。 03.有离子键的化合物一定是离子化合物,离子化合物中一定有离子键,可能有共价键,如NaOH。 04.原子间通过共用电子对形成的相互作用称为共价键。 05.共...
 [导学与精要9] 晨读笔记:元素周期律 作者:化学自习室 来源:未知 日期:2023-08-09 16:44:08 点击:807 所属专题:元素周期律
[导学与精要9] 晨读笔记:元素周期律 作者:化学自习室 来源:未知 日期:2023-08-09 16:44:08 点击:807 所属专题:元素周期律
01.原子最外层电子排布变化规律: 同周期由左向右元素的原子最外层电子数逐渐增加(1→8)(第一周期1→2) 02.元素的主要化合价: ①同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价); ②元素的最低负价由Ⅳ a 族的-4价逐渐升高至Ⅶ a 族的-1价; 03.同...
 [教材分析] 教材分析(必修二):无机物的化学性质 作者:张德金 来源:未知 日期:2023-08-09 11:51:21 点击:872 所属专题:化学性质
[教材分析] 教材分析(必修二):无机物的化学性质 作者:张德金 来源:未知 日期:2023-08-09 11:51:21 点击:872 所属专题:化学性质
无机物的化学性质包括金属性与非金属性,酸性与碱性,氧化性与还原性,不稳定性,挥发性、溶解性、电离能力等引起的化学反应。 一、金属性与非金属性 1 、金属性 金属性体现在金属单质的还原性,金属对应的氧化物是碱性氧化物,金属的氧化物对应的水化物是碱等。 在此只...
 [教材分析] 教材分析(必修二):氮及其化合物 作者:张德金 来源:未知 日期:2023-08-09 10:49:37 点击:764 所属专题:氮及其化合物
[教材分析] 教材分析(必修二):氮及其化合物 作者:张德金 来源:未知 日期:2023-08-09 10:49:37 点击:764 所属专题:氮及其化合物
一、氮 1 、 “ 位 - 构 - 性 ” ( 1 )位置:第二周期 VA 族。 ( 2 )结构: ( 3 )性质:(预测) ①氧化性:最外层能得 3 电子,反应后显 -3 价,显示为氧化性。与金属钠反应:生成 Na 3 N 。与金属 Mg 反应:生成 Mg 3 N 2 。 ②还原性:自然界中能看到稳定的 +5...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
...
(一)氮气 1. 氮元素的存在 既有游离态又有化合态。它以双原...
...
...
氯化硫介绍 氯化硫(即二氯化二硫),有特殊气味。在空气中发...
一、复分解反应 1、与非氧化性酸发生的复分解反应 Na 2 S 2 O 3...
按阿莱-罗周电负性标度: n (的电负性为)3.07,Cl的电负性为2.8...