
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
无机物的化学性质包括金属性与非金属性,酸性与碱性,氧化性与还原性,不稳定性,挥发性、溶解性、电离能力等引起的化学反应。
一、金属性与非金属性
1、金属性
金属性体现在金属单质的还原性,金属对应的氧化物是碱性氧化物,金属的氧化物对应的水化物是碱等。
在此只分析金属单质的还原性。
(1)与非金属的反应
①与O2反应:除特别活泼金属能生成过氧化物之外,一般生成氧化物。
2Zn+O2 2ZnO
2ZnO
2Na+O2 Na2O2
Na2O2
对于多种价态的Fe,与氧气点燃生成Fe3O4。
3Fe+2O2 Fe3O4
Fe3O4
②与Cl2、Br2反应:Fe和Cu生成高价化合物。
2Fe+3Cl2 2FeCl3、
2FeCl3、
2Fe+3Br2 2FeBr3
2FeBr3
Cu+Cl2 CuCl2、
CuCl2、
Cu+Br2 CuBr2
CuBr2
③与I2、S反应:Fe和Cu生成低价化合物。
Fe+I2 FeI2、
FeI2、
Fe+S FeS
FeS
2Cu+I2 2CuI、
2CuI、
2Cu+S Cu2S
Cu2S
④与N2反应:Mg、Na等活泼金属N2反应。不太活泼的金属与N2不反应。
3Mg+N2 Mg3N2、
Mg3N2、
6Na+N2 2Na3N
2Na3N
(2)与H2O(液态)、稀HCl或稀H2SO4、稀HNO3反应
H2O(液态)、稀HCl或稀H2SO4、稀HNO3反应的氧化性越来越强。
H2O(液态)只和很活泼的金属反应,稀HCl或稀H2SO4与大多数金属能反应,稀HNO3和不活泼的Cu、Hg、Ag也能反应。
Mg+2H2O Mg(OH)2+H2↑
Mg(OH)2+H2↑
Fe+H2SO4=FeSO4+H2↑
3Ag+2HNO3(稀) =3AgNO3+NO↑+2H2O
(3)金属与其它一些氧化物反应
活泼金属可能在CO2中燃烧:2Mg+CO2 2MgO+C
2MgO+C
活泼金属Al与一些不太活泼金属氧化物在高温下能反应:
4Al+3MnO2 2Al2O3+3Mn
2Al2O3+3Mn
(4)与盐的反应:
①置换反应
Fe+CuSO4=FeSO4+Cu
Al+3AgNO3=Al(NO3)3+3Ag
②金属与氧化性盐能反应
Cu+2FeCl3=CuCl2+2FeCl2
2、非金属性
非金属性体现在非金属单质的氧化性,非金属对应的氧化物是酸性氧化物,非金属的氧化物对应的水化物是酸等。
(1)与金属的反应(见金属性)
(2)氧化性非金属与还原性非金属的反应
有些非金属以氧化性为主,如F2、Cl2、Br2、O2。有些非金属以还原性为主,如Si、P、C和H2。有些非金属的还原性氧化性都不强,如S、I2、N2。
H2+Br2 2HBr
2HBr
S+O2 SO2
SO2
S+H2 H2S
H2S
N2+O2 2NO
2NO
N2+3H2 2NH3
2NH3
Si+2Cl2 SiCl4
SiCl4
(3)非金属与其它一些氧化物反应
C+CO2 2CO
2CO
C+H2O CO+H2
CO+H2
C+2SO3 CO2+2SO2
CO2+2SO2
C+2CuO 2Cu+CO2↑
2Cu+CO2↑
3H2+Fe2O3 2Fe+3H2O
2Fe+3H2O
(4)与碱的反应
多数发生歧化反应:
Cl2+2NaOH=NaCl+NaClO+H2O(Br2、I2类似)
3Cl2+6NaOH 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
3S+6NaOH 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O
8P+24NaOH 5Na3P+3Na3PO4+12H2O
5Na3P+3Na3PO4+12H2O
有的发生氧化反应:
Si+2NaOH+H2O=Na2SiO3+2H2↑
(5)与盐的反应:
①置换反应
Cl2+2NaBr=2NaCl+Br2
Br2+2KI=2KBr+I2
2Na2S(aq)+O2+2H2O=S↓+4NaOH
②还原性的非金属与强氧化性盐溶液能反应
5S+6KMnO4+4H2SO4=3K2SO4+6MnSO4+4H2O
3、金属、非金属的其它反应
(1)金属与碱反应。
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2)还原性的非金属与强氧化性酸能反应
S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
二、酸性与碱性
1、显酸性的物质和显碱性的物质
(1)显酸性的物质
酸性氧化物、酸、酸式盐、强酸弱碱盐。
(2)显碱性的物质
碱性氧化物、碱、碱式盐、强碱弱酸盐。
2、中和反应和类似于中和反应
(1)酸性氧化物、酸、酸式盐+碱性氧化物、碱、碱式盐=盐(+水)
注意:特别弱的酸和特别弱的碱不一定能反应,如CO2与Cu(OH)2。
SO2+Ba(OH)2=BaSO3↓+H2O
FeO+2HI=FeI2+H2O
Ca(OH)2+2HClO=Ca(ClO)2+2H2O
K2O+SO3=K2SO4
NaHCO3+NaOH=Na2CO3+H2O
Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
(2)【注意】多元弱酸反应时的过量问题
①H2S+NaOH(少)=NaHS+H2O
H2S+2NaOH(多)=Na2S+2H2O
类似的还有H2C2O4(草酸)、H3PO4等。
②CO2+NaOH(少)=NaHCO3
CO2+2NaOH(多)=Na2CO3+H2O
类似的还有SO2、P2O5等。
(3)【注意】发生氧化还原反应
3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O
3Fe(OH)2+10HNO3(稀)=3Fe(NO3)3+NO↑+8H2O
Fe2O3+6HI=2FeI2+I2+3H2O
2Fe(OH)3+6HI =2FeI2+I2+6H2O
3、强酸制弱酸和强碱制弱碱
(1)强酸制弱酸
反应格式:强一点的酸+弱酸盐=弱酸+强一点的酸的盐
HBr+CH3COOK=CH3COOH+KBr
SO2+NaHCO3=NaHSO3+CO2
CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓
需要注意的是,要对酸的酸性强弱有了解。
常见的强酸有:HCl、H2SO4、HNO3、HBr、HI、HClO4等。
比H2CO3强的弱酸:CH3COOH、H3PO4、H2C2O4、H2SO3。
H2CO3等。
比H2CO3弱的弱酸:H2SiO3、HClO、Al(OH)3等。
【注意】制多元弱酸时,也有过量问题。
Na2S+HCl(少)=NaHS+NaCl
类似的还有Na2CO3、Na2SO3、Na2C2O4(草酸钠)、Na3PO4等。
NaAlO2+4HCl(多) =AlCl3+NaCl+2H2O
【注意】有可能发生氧化还原反应。
SO2(少)+H2O+NaClO =NaCl+H2SO4
HI+3NaClO=HIO3+3NaCl
2HNO3(稀)+3Na2SO3=3Na2SO4+2NO↑+H2O
(2)强碱制弱碱
反应格式:强一点的碱+弱碱盐=弱碱+强一点的碱的盐
Ba(OH)2+CuCl2=BaCl2+Cu(OH)2↓
3NH3·H2O+AlCl3=3NH4Cl+Al(OH)3↓
需要注意的是,要对碱的碱性强弱有了解。
常见的强碱有:NaOH、KOH、Ba(OH)2、Ca(OH)2。
比其它弱碱都强的弱碱:NH3·H2O。
其它弱碱:Mg(OH)2、Al(OH)3、……AgOH
【注意】AlCl3与过量强碱反应时,有过量问题。
AlCl3+4NaOH(多)=NaAlO2+3NaCl+2H2O
三、氧化性与还原性
1、所有化合物都有氧化性和还原性。但只有氧化性较强的物质和还原性较强的物质才有可能发生氧化还原反应。
2、常见的氧化剂、还原剂及对应的产物
(1)常见的氧化剂及对应的产物:
氧化剂 | 产物价态 | 产物形态 |
O2、O3 | -2 | H2O、OH-、含氧化合物 |
Cl2 | -1 | Cl-氯化物 |
Br2 | -1 | Br-溴化物 |
H2O2 | -2 | H2O、OH- |
Na2O2 | -2 | 含氧化合物 |
浓HNO3 | +4 | NO2 |
稀HNO3 | +2 | NO |
浓H2SO4 | +4 | SO2 |
MnO4- | +2 | Mn2+ |
Cr2O72- | +3 | Cr3+ |
ClO- | -1 | Cl-氯化物 |
Fe3+ | +2 | Fe2+ |
(2)常见的还原剂及对应的产物:
还原剂 | 产物价态 | 产物形态 |
金属 | 金属离子 | |
C | +4 | CO2或CO32- |
H2 | +1 | 氢化物等 |
S | +4或+6 | SO2或SO42- |
S2- | 0 | S |
SO2或SO32- | +6 | SO3、SO42- |
I- | 0 | I2 |
Fe2+ | +3 | Fe3+ |
3、利用上面的氧化剂和还原剂创造出一些氧化还原反应
(1)2P+5H2SO4(浓) 2H3PO4+5SO2↑+2H2O
2H3PO4+5SO2↑+2H2O
(2)Ag+2HNO3(浓)=AgNO3+NO2↑+H2O
(3)5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
(4)6FeCl2+3H2O2=2Fe(OH)3↓+4FeCl3
(5)2Na2S(aq)+O2+2H2O=S↓+4NaOH
(6)2KI+NaClO+H2SO4=K2SO4+I2+NaCl+H2O
(7)6FeSO4+K2Cr2O7+7H2SO4= 3Fe2(SO4)3+K2SO4+Cr2(SO4)3+7H2O
4、不稳定的价态有强氧化性或还原性,具体有哪种性质要看旁边的稳定价态的高低。
比如在H2O2中,-1价的氧的价态不稳定,而氧的稳定价态为-2价,较稳定价态为0价。所以H2O2经常显示出强氧化性,碰到更强的氧化剂时,也能显示出还原性。
H2O2+SO2=H2SO4
5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
5、重视物质的还原性或氧化性的掌握
特别是可能发生复分解反应,结果却是氧化还原反应的可能。
(见酸碱中和和强酸制弱酸中的氧化还原反应)
例如,物质的化学性质练习
马日夫盐【Mn(H2PO4)2·2H2O】用于大型机械设备的磷化处理,可起到防锈作用。一种以软锰矿(主要成分为MnO2,含少量FeO、Al2O3和SiO2)为原料生产马日夫盐的工艺流程如图所示:
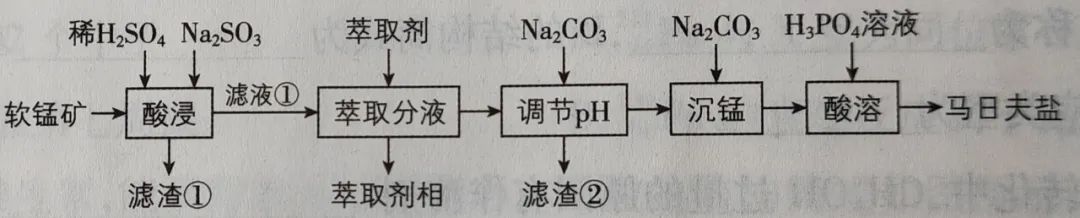
提示:萃取分液分离掉Fe3+。
写出“酸浸”时发生的反应:
(1)FeO被氧化为Fe3+,根据Mn由+4价最后变为+2价,所以MnO2做氧化剂:
2FeO+MnO2+4H2SO4=Fe2(SO4)3+MnSO4+4H2O
(2)MnO2的量比FeO要多,剩余的MnO2变为MnSO4,需要还原剂Na2SO3:
MnO2+Na2SO3+H2SO4= MnSO4+Na2SO4+H2O
(3)Al2O3不发生氧化还原反应,只与稀H2SO4发生复分解反应:
Al2O3+3H2SO4=Al2(SO4)3+3H2O
(4)SiO2没有明显的氧化性和还原性,与MnO2、FeO、Na2SO3都不发生反应。SiO2是酸性氧化物,与稀H2SO4不发生复分解反应。所以SiO2不反应,不溶解,过滤为滤渣①。
四、不稳定性与挥发性
1、物质如果不稳定,会容易发生分解反应。如果分解时需要加热或高温,有些反应的发生还与物质的挥发性或处于气态有关。
2、不稳定的一些物质
(1)含氧酸
①常温下不稳定,会分解的:H2CO3、H2SO3等。
②加热下不稳定的:HClO、HNO3等
2HClO 2HCl+O2↑
2HCl+O2↑
4HNO3 2H2O+4NO2↑+O2↑
2H2O+4NO2↑+O2↑
③更高的温度下不稳定的:H2SO4等。
H2SO4 H2O+SO3↑
H2O+SO3↑
(2)弱碱不稳定,受热易分解。
NH3·H2O NH3↑+H2O
NH3↑+H2O
Mg(OH)2 MgO+H2O
MgO+H2O
……
Cu(OH)2 CuO+H2O
CuO+H2O
【注意】汞和银的氢氧化物热分解时,会生成金属。
4AgOH 4Ag+O2↑+2H2O
4Ag+O2↑+2H2O
【注意】Fe(OH)2在空气中热分解时,易被氧化。
4Fe(OH)2+O2 2Fe2O3+4H2O
2Fe2O3+4H2O
(3)多数碳酸盐不稳定,受热易分解。
MgCO3 MgO+CO2↑
MgO+CO2↑
……
CuCO3 CuO+CO2↑
CuO+CO2↑
【注意】汞和银的碳酸盐热分解时,会生成金属。
2Ag2CO3 4Ag+2CO2↑+O2↑
4Ag+2CO2↑+O2↑
【注意】FeCO3在空气中热分解时,易被氧化。
4FeCO3+O2 2Fe2O3+4CO2↑
2Fe2O3+4CO2↑
(4)铵盐不稳定,受热易分解。
NH4Cl NH3↑+HCl↑
NH3↑+HCl↑
NH4HCO3 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
【注意】有些铵盐受热会发生氧化还原反应。
NH4NO3=190℃= N2O↑+2H2O
NH4NO3=300℃= N2↑+ O2↑+ 4H2O
3(NH4)2SO4=3SO2↑+6H2O+ 4NH3↑+ N2↑
(5)硝酸盐不稳定,受热易分解。
①K、Ca、Na等活泼金属:2NaNO3 2NaNO2+O2↑
2NaNO2+O2↑
②Mg到Cu等金属:2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
③Hg、Ag等不活泼金属:2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
【注意】4Fe(NO3)2 2Fe2O3+8NO2↑+O2↑
2Fe2O3+8NO2↑+O2↑
(6)酸式盐不稳定,受热易分解。
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【注意】NaHSO3、NaHS等受热分解的反应都比较复杂,有氧环境和无氧环境的反应也不同。
2NaHSO3(s)=Na2SO3+H2O+SO2↑
2NaHSO3(aq) Na2S2O5(AQ,焦亚硫酸钠)+H2O(继续加热被氧气氧化为Na2SO4)
Na2S2O5(AQ,焦亚硫酸钠)+H2O(继续加热被氧气氧化为Na2SO4)
(7)不稳定价态也会导致发生不稳定性的反应。
2H2O2 H2O+O2↑
H2O+O2↑
2NaClO(s) 2NaCl+O2↑
2NaCl+O2↑
3NaClO(aq) NaClO3+2NaCl
NaClO3+2NaCl
H2C2O4 H2O+CO↑+CO2↑
H2O+CO↑+CO2↑
Na2C2O4 Na2CO3+CO↑
Na2CO3+CO↑
4Na2SO3 3Na2SO4+Na2S
3Na2SO4+Na2S
3、加热或高温下的反应,与稳定性、挥发性有关,有些和酸碱性强弱、氧化性还原性强弱无关。
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
Na2CO3+Al2O3 2 NaAlO2+CO2↑
2 NaAlO2+CO2↑
Na2CO3+CO2O3 2NaCOO2+CO2↑
2NaCOO2+CO2↑
KCl+Na NaCl+K↑
NaCl+K↑
2NaCl+H2SO4(浓) Na2SO4+2HCl↑
Na2SO4+2HCl↑
例,以铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质)为原料制备重铬酸钾(K2Cr2O7)的流程图如下:
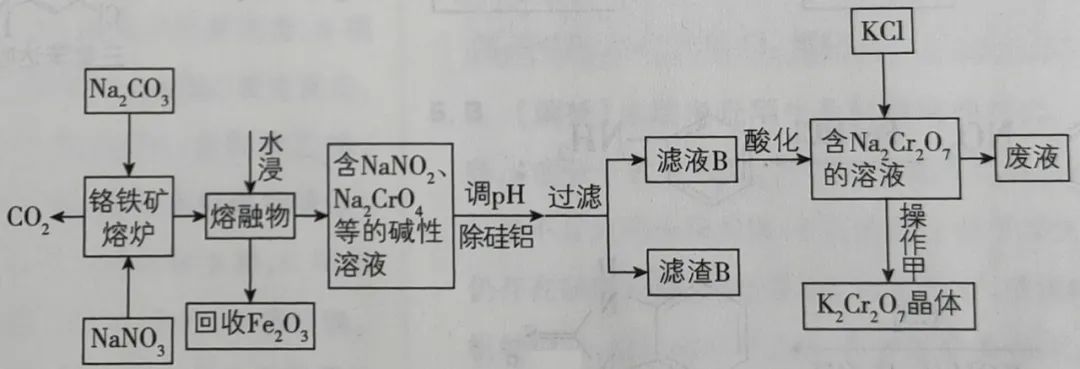
加入Na2CO3和NaNO3时,NaNO3为氧化剂,产物为NaNO2,写出此处的反应:
2FeO·Cr2O3+7NaNO3+4 Na2CO3 Fe2O3+4Na2CrO4+7 NaNO2+4CO2↑
Fe2O3+4Na2CrO4+7 NaNO2+4CO2↑
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
Na2CO3+Al2O3 =高温=2 Na2+CO2↑
=高温=2 Na2+CO2↑
五、溶解性、电离能力等引起的化学反应
1、溶解性引起的化学反应:易溶盐制难溶盐。
Na2SO3+CaBr2=CaSO3↓+2NaBr
(NH4)2CO3+Ba(NO3)2=BaCO3↓+2NH4NO3
难溶、微溶的盐有
阳离子 | 阴离子 |
Ba2+、Ca2+、Ag+ | SO42- |
Ca2+、Ba2+、Mg2+ | CO32-、SO32-、PO43-、HPO42-、C2O42- |
Ag+ | Cl-、Br-、I- |
Ag+、Cu2+、Hg2+、Pb2+ | S2- |
【注意】弱酸根和弱碱阳离子易发生双水解反应(与水反应生成弱酸和弱碱)。例如
2AlCl3+3Na2CO3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl
2、电离能力引起的化学反应:易电离物质生成难电离物质。
中和反应生成水,强酸制弱酸,强碱制弱碱,都是易电离物质生成难电离物质(弱酸、弱碱、水、少量盐)。
除此之外还有生成一些难电离的盐或离子:
FeCl3+3KSCN=Fe(SCN)3+3KCl Fe(SCN)3为难电离盐。
2CH3COONa+Pb(NO3)2=(CH3COO)2Pb+2NaNO3 (CH3COO)2Pb为难电离盐。
CuSO4+H2S=CuS↓+H2SO4 CuS为难溶难电离的物质。
Cu(OH)2+4NH3·H2O=[Cu(NH3)4](OH)2+4H2O [Cu(NH3)4]2+为难电离的离子。
【课后练习】
1、由一种钴矿石(主要成分为Co2O3,含少量Fe2O3、Al2O3、MgO、CaO等杂质)制取Co2O3的工艺流程如图所示:
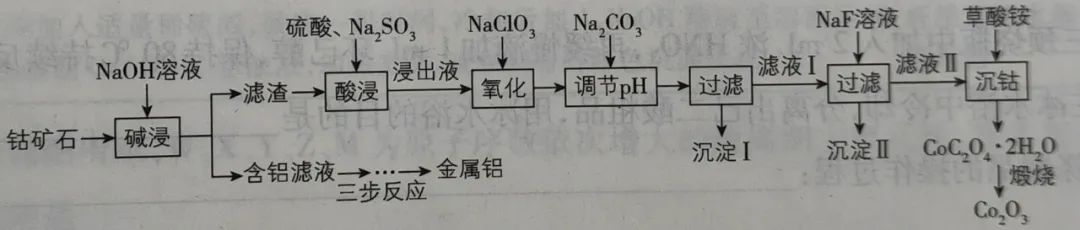
提示:NaF与Ca2+、Mg2+生成沉淀。
写出各环节发生的化学反应方程式。
2、钒酸铋(BiVO4)是一种对人体无害、环保低碳的亮黄色颜料,一种用高硅钒矿(主要含SiO2、V2O5以及少量CaO、MgO、Fe2O3、Al2O3等)制备钒酸铋的流程图如下:
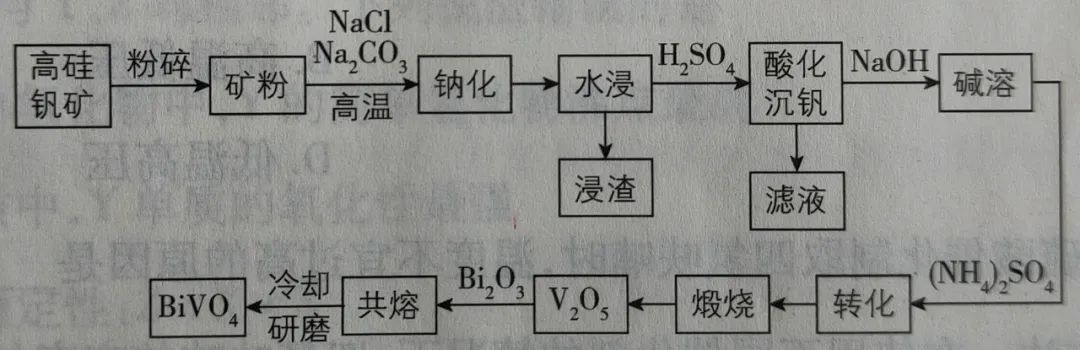
提示:“钠化”过程生成Na3VO4。
写出各环节发生的化学反应方程式。
【课后练习答案】
1、(1)写出“酸浸”时发生的反应:
滤渣中含有Co2O3、Fe2O3、MgO、CaO。
①根据CO由+3价最后变为+2价,在此处被还原剂Na2SO3还原:
Co2O3+Na2SO3+2H2SO4=2CoSO4+Na2SO4+2H2O
②Fe2O3也有氧化性,也能被还原剂Na2SO3还原:
Fe2O3+Na2SO3+2H2SO4=2FeSO4+Na2SO4+2H2O
③MgO不发生氧化还原反应,只与稀H2SO4发生复分解反应:
MgO+H2SO4=MgSO4+H2O
④CaO不发生氧化还原反应,只与稀H2SO4发生复分解反应:
CaO+H2SO4=CaSO4+H2O
CaSO4在水中的溶解度低,所以溶液中的CaSO4的含量较少。
(2)写出“氧化”时发生的反应:
根据CO最后保持+2价,可以判断在此处CO2+没有被氧化。但Fe2+有强还原性,能被氧化剂NaClO3氧化。所以反应为
6FeSO4+NaClO3+3H2SO4=3Fe2(SO4)3+NaCl+3H2O
(3)写出“调节pH”时发生的反应:
Na2CO3不具有强氧化性和强还原性,此处发生的是复分解反应。结合后面的“加NaF”,可推理出此处除掉Fe3+。所以反应为
Fe2(SO4)3+3Na2CO3+3H2O= 2Fe(OH)3↓+3CO2↑+3Na2SO4
(4)写出“加NaF”时发生的反应:
NaF不具有强氧化性和强还原性,根据“沉淀II”和前面的“提示”,此处发生的是除掉Ca2+、Mg2+的复分解反应,生成CaF2、Mg F2沉淀。所以反应为
CaSO4+2NaF=CaF2↓+ Na2SO4
MgSO4+2NaF=MgF2↓+ Na2SO4
(5)写出“加草酸铵”时发生的反应:
草酸铵有强还原性,但根据“沉钴”和CoC2O4·2H2O,此处发生的是复分解反应,生成CoC2O4·2H2O沉淀。所以反应为
CoSO4+(NH4)2C2O4+2H2O=CoC2O4·2H2O↓+ (NH4)2SO4
(6)写出“煅烧”时发生的反应
反应中CO由+2价变为+3价,推理可知C的化合价得由+3价降到+2价。但在此氧化还原过程中,+3价的C有剩余,自身发生歧化反应,生成CO和CO2。所以反应为
2CoC2O4·2H2O Co2O3+3CO↑+CO2↑+2H2O
Co2O3+3CO↑+CO2↑+2H2O
(7)三步制铝的反应为
NaAlO2+CO2(过量)+H2O=Al(OH)3↓+NaHCO3
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
2Al2O3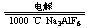 4Al+3O2↑
4Al+3O2↑
2、(1)写出“钠化”处的反应
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
Na2CO3+Al2O3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
3Na2CO3+V2O5 2Na3VO4+3CO2↑
2Na3VO4+3CO2↑
CaO、MgO、Fe2O3在此处不反应。
(2)写出“酸化沉矾”处的反应
Na2SiO3+H2SO4=H2SiO3↓+Na2SO4
2Na3VO4+3H2SO4=2H3VO4↓+3Na2SO4
2NaAlO2+4H2SO4=Na2SO4+Al2(SO4)3+4H2O
(3)写出“碱溶”处的反应
H2SO4+2NaOH=Na2SiO3+2H2O
2H3VO4+6NaOH=2Na3VO4+6H2O
(4)写出“转化”处的反应
3(NH4)2SO4+2Na3VO4=2(NH4)3VO4↓+3Na2SO4
(5)写出“煅烧”处的反应
2(NH4)3VO4 V2O5+6NH3↑+3H2O
V2O5+6NH3↑+3H2O
(6)写出“共熔”处的反应
V2O5+Bi2O3=共熔=2BiVO4

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的,...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠...