
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氮
1、“位-构-性”
(1)位置:第二周期Va族。
(2)结构:
![]()
(3)性质:(预测)
①氧化性:最外层能得3电子,反应后显-3价,显示为氧化性。与金属钠反应:生成Na3N。与金属Mg反应:生成Mg3N2。
②还原性:自然界中能看到稳定的+5价,说明氮具有一定的还原性。
但氮既不易失电子,也不易得电子,更容易以形成共用电子对的方式构成物质。
③氧化性比较:实际上N2比O2的氧化性差很多,还有一个原因是N2中N之间的共价键比O2的O之间的共价键强很多,更不容易断裂所致。【推理】
2、氮气的物理性质
颜色?状态?气味?毒性?溶解性?密度?熔沸点?
无色无味无毒的气体。溶解性:难溶于水。
【推理】密度:与空气相近。熔沸点:很低。
氮气由分子构成,分子之间为分子间作用力,分子的相对分子质量很小,所以熔沸点很低。
3、氮气的化学性质(从金属、非金属、氧化物、酸、碱、盐等角度分析)
(1)与金属反应:Na或Mg在空气中燃烧时,会产生少量的氮化物。
3Mg+N2 Mg3N2
Mg3N2
(2)与非金属反应:
N2若与氧化性非金属反应,显示为还原性。
N2+O2 2NO
2NO
N2若与还原性非金属反应,显示为氧化性。
N2+3H2 2NH3
2NH3
这是工业制氨的反应,也是工业制氮的化合物的重要反应。
(3)与常见的氧化物、酸、碱、盐一般不反应。
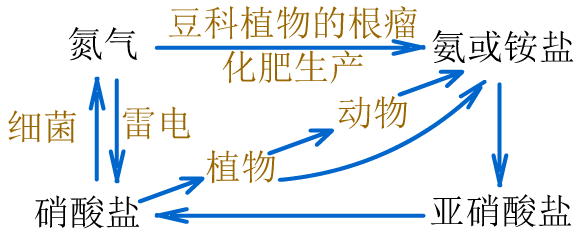
(4)氮的固定:把游离态的氮转化为氮的化合物。
大自然通过闪电或根瘤菌能实现自然固氮。
4、金属氮化物的化学性质
(1)遇水能水解。
Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(2)遇酸能反应生成两种盐。
Mg3N2+8HCl=3MgCl2+2NH4Cl
二、NO和NO2
1、NO的物理性质
颜色?状态?气味?毒性?溶解性?密度?熔沸点?
无色、有毒气体,不溶于水。
【推理】密度与空气相近。
熔沸点:比N2稍高。(分子的极性越高,分子间作用力越大)
2、NO的化学性质
遇空气生成红棕色的NO2。
2NO+ O2=2NO2
3、NO2的物理性质

颜色?状态?气味?毒性?溶解性?密度?熔沸点?
红棕色、有刺激性气味的有毒气体,易溶于水
【推理】密度比空气大。
熔沸点:易液化,熔沸点比NO高很多。(NO2在低温下易形成N2O4,使相对分子质量变大,分子间作用力变大)
注意:NO2在标准状况下是液体。
4、NO2的化学性质
(1)溶于水时会有一部分与水反应,生成HNO3和NO。
3NO2+H2O=2HNO3+NO
(2)NO2气体内存在着生成N2O4的平衡。
2NO2⇌ N2O4
所以NO2气体中含有N2O4。(N2O4为无色气体)
5、NO、NO2的其它化学性质
(1)NO2和O2混合气体与水反应,能全部生成HNO3。
4NO2+O2+2H2O=4HNO3
(2)NO和O2混合后与水反应,能全部生成HNO3。
4NO +3O2+2H2O=4HNO3
(3)NO2与NaOH溶液反应,生成NaNO3和NaNO2。
2NO2+2NaOH=NaNO3+NaNO2+H2O
(4)NO、NO2的混合气体与NaOH溶液反应,生成NaNO2。
NO+NO2+2NaOH=2NaNO2+H2O
三、NH3和铵盐
1、NH3的物理性质
颜色?状态?气味?毒性?溶解性?密度?熔沸点?
无色、有刺激性气味的气体。
【推理】密度比空气小。
熔沸点:熔沸点比N2高。(分子之间有氢键)
易液化,液氨气化时吸收大量能量,可以用作致冷剂。
【实验】氨气溶于水的喷泉实验
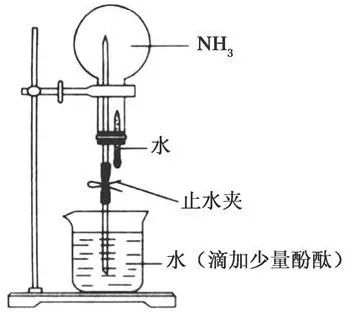
此实验证实了,氨气易溶于水,氨气溶于水会显碱性。
常温常压下1体积的水中大约可溶解700体积的氨气。
氨水的密度小于水的密度,浓度越大,密度越小。
2、NH3的化学性质
(1)遇水显碱性。
NH3+H2O⇌NH3·H2O⇌NH4++OH-
氨水(主要成分为NH3·H2O)能使酚酞溶液变红或使蓝色石蕊试纸变蓝。
氨与酸生成铵盐。氨气遇氯化氢时,会产生白烟。
NH3+HCl=NH4Cl

(2)有很强的还原性。
①在催化剂的作用下,能与O2反应,生成NO。
4NH3+5O2 4NO+6H2O
4NO+6H2O
②能还原CuO。
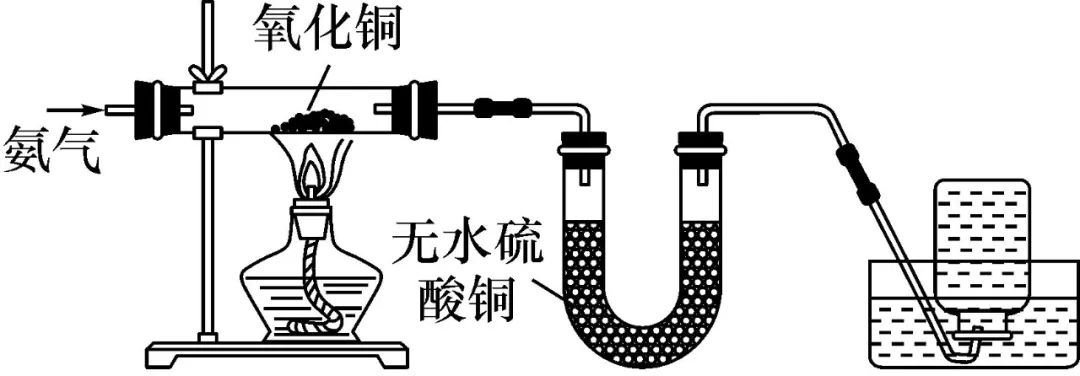
2NH3+3CuO 3Cu+N2+3H2O
3Cu+N2+3H2O
③能与Cl2反应。
2NH3+3Cl2=6HCl+N2
或8NH3+3Cl2=8NH4Cl+N2
3、铵盐的物理性质

多数为无色晶体,有的是白色固体,易溶于水。受热易分解,很多无熔沸点。有氨的气味。密度比水大。
4、铵盐的化学性质
(1)铵盐易分解。
NH4Cl NH3↑+HCl↑
NH3↑+HCl↑
NH4HCO3 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
(2)铵盐是弱碱盐,可以用强碱与铵盐反应,制取氨气。
NH4Cl+NaOH(浓) NH3↑+NaCl+H2O
NH3↑+NaCl+H2O
NH4Cl+NaOH=NH3·H2O+NaCl
由于氨气极易溶于水并且与水形成NH3·H2O,生成量浓度较低时,写NH3·H2O。生成量浓度较高时,写NH3↑+H2O。
(3)NH3的实验室制法
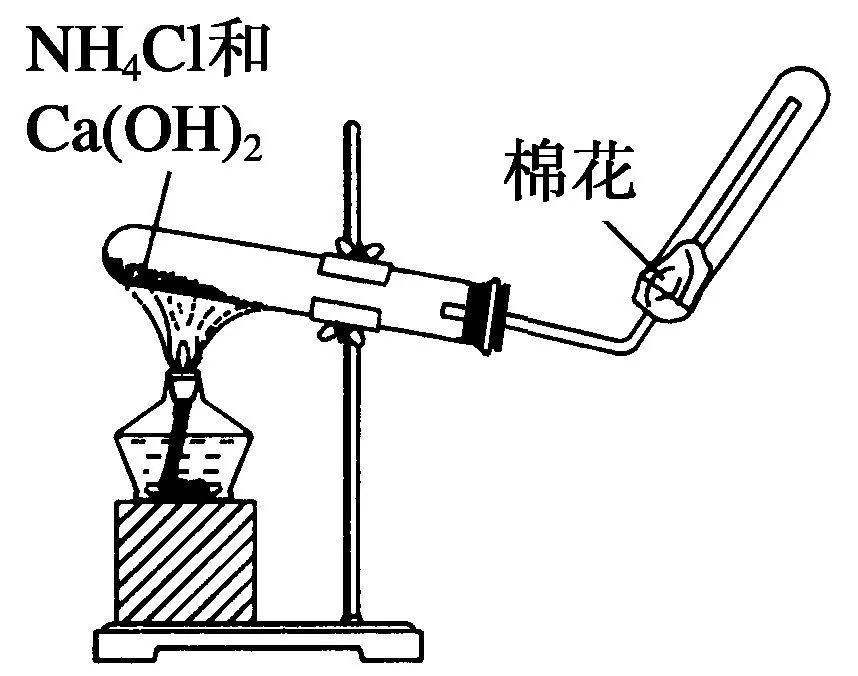
①反应原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
②收集方法:向下排气法。(为什么不能用排水法?)
③检验氨气:用湿润的红色石蕊试纸,现象为试纸变蓝。
④若干燥氨气:用干燥管和碱石灰。
不能用无水氯化钙或浓硫酸吸收。(为什么?)
⑤若进行尾气处理:防倒吸,用水或稀硫酸吸收。
⑥棉花团的作用:防止氨气与空气对流。
⑦不能用NaOH固体,NaOH易与玻璃中的SiO2反应,使试管破裂。
5、铵盐是农业的重要肥料。

左侧为缺少氮肥的植物,右侧为氮肥施加正常的植物
四、硝酸和硝酸盐
1、纯硝酸、浓硝酸、稀硝酸
(1)纯硝酸:无色、有刺激性气味的液体,易挥发,与水以任意比混溶。密度(1.51g·cm-3)大于水。
纯硝酸中HNO3以分子形式存在,分子之间有氢键,不发生电离,纯液体状态下不导电。
熔点-42℃,沸点83℃。熔沸点较高,原因是分子之间有氢键。但熔沸点比浓硫酸低,原因是HNO3分子也会形成分子内氢键。
(2)浓硝酸:发烟硝酸的质量分数为98%。平时用的浓硝酸的质量分数为68%。
①不稳定:易分解为NO2、O2和H2O。所以一般保存在棕色试剂瓶中,并放置在阴凉处。
4HNO3 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
浓硝酸一般呈黄色,是因为易分解,生成NO2并溶于浓硝酸。
②强氧化性:不仅能氧化Mg、Zn等活泼金属,还能氧化Cu、Ag等不太活泼的金属和非金属C、S等。自身生成NO2。
Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
③钝化:Al、Fe遇到浓硝酸也会发生钝化现象。常温下可以用铁或铝制容器盛装浓硝酸。
(3)稀硝酸:低于6mol·L-1的硝酸。具有强酸性和强氧化性,还原产物一般为NO。若硝酸的浓度更低,还原产物还可能为N2O、N2、铵盐等。
Fe2O3+6HNO3=2Fe(NO3)3+3H2O
3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O
3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O
4Zn+10HNO3(极稀)=4Zn(NO3)2+NH4NO3+3H2O
(4)工业制硝酸的流程
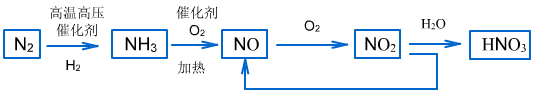
2、硝酸盐
(1)物理性质:固体,绝大多数易溶于水。
在农业上可以用作肥料。
(2)化学性质:不稳定,受热易分解。与可燃物一起易发生爆炸,属于危险品。
分解规律如下
碱金属及碱土金属的硝酸盐:2NaNO3 2NaNO2+O2↑
2NaNO2+O2↑
镁到铜:2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
银:2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
(3)检验NO3-的方法:
在酸性介质中,通过和FeSO4反应产生棕色环[Fe(NO)]SO4加以定性检出。
五、酸雨及防治
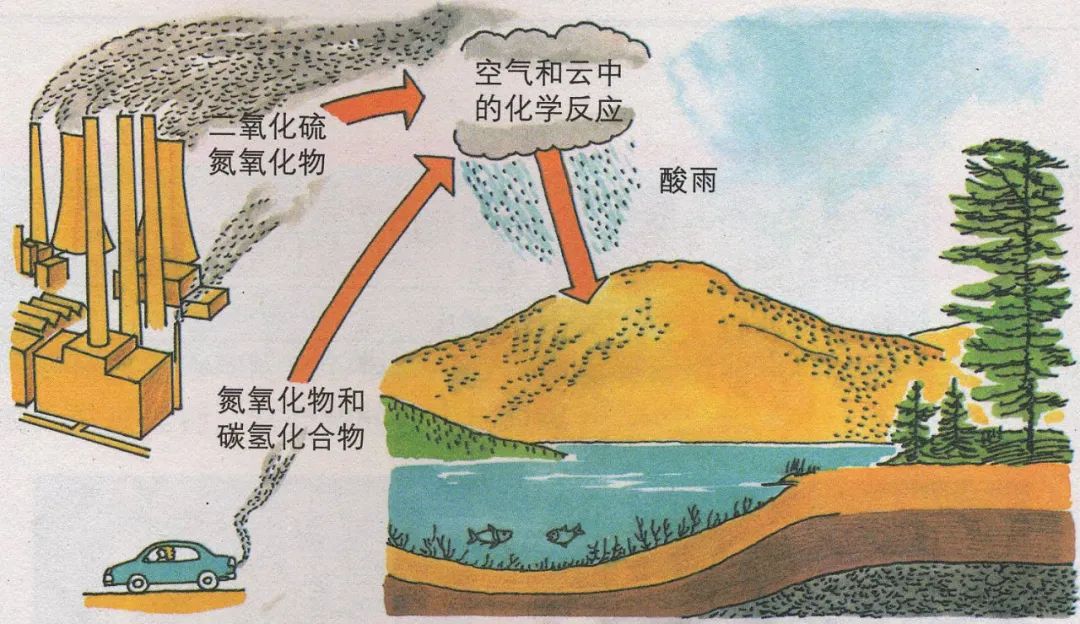
1、正常雨水:pH值约为5.6,溶解CO2所致。酸雨的pH小于5.6。
2、酸雨的形成原因:
化石燃料或矿物在燃烧或冶炼时会产生SO2,机动车发动机会产生氮氧化物,SO2和氮氧化物以及它们在大气中发生反应的生成物溶于水会形成酸雨。
3、酸雨的危害:
损伤农作物,破坏草原、森林,使土壤、湖泊酸化,加速建筑物、桥梁、工业设备、运输工具、电缆的腐蚀等。
4、酸雨的预防:
家用燃料改用去硫的燃气,工业废气在排放前要处理,机动车废气要进行催化处理等。
六、亚硝酸及亚硝酸盐
1、不同价态含氮物质的价类二维图
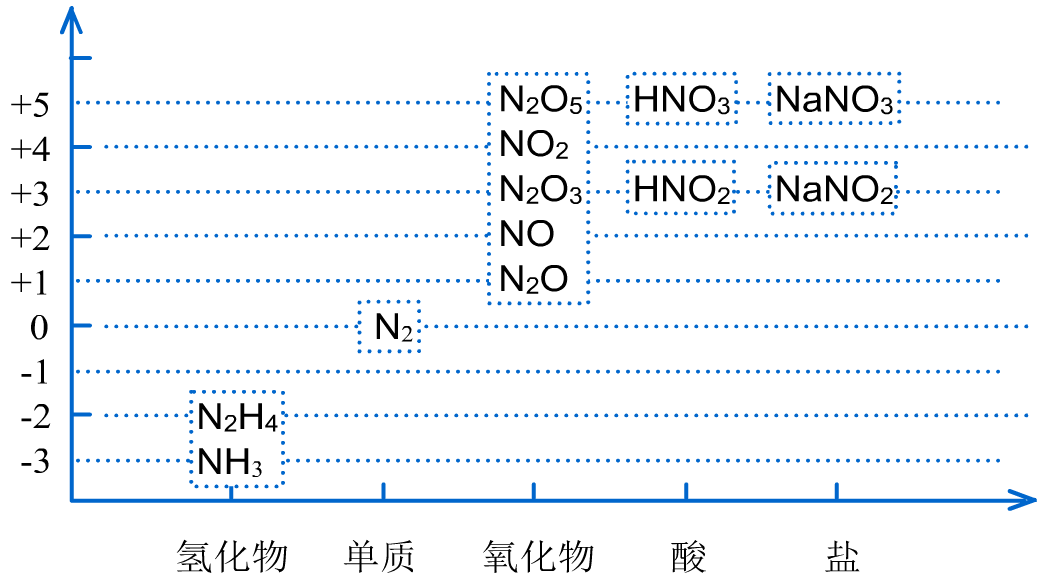
2、亚硝酸只存在于稀的水溶液中,亮蓝色,是弱酸。亚硝酸的盐类大多数是无色结晶,易溶于水,有毒。
NaNO2+H2SO4=NaHSO4+HNO2
亚硝酸溶液遇微热即分解。
2HNO2=NO↑+NO2↑+H2O
3、亚硝酸及亚硝酸盐既有氧化性,又有还原性。
酸性KMnO4溶液、Cl2、O2等,能氧化NO2-。
NO2-+Cl2+H2O=NO3-+2H++2Cl-
2NaNO2+O2=2NaNO3
NO2-能氧化I-等。
2HNO2+2I-+2H+=2NO↑+I2+2H2O
4、亚硝酸盐是一种食品防腐剂,能防止食品腐败变质,具有显著的杀菌或抑菌效能,特别是在腌肉工业上得到广泛应用。但亚硝酸钠有一定毒性,食入0.3~0.5克的亚硝酸盐即可引起中毒,3克导致死亡。它还有一定的致癌性,在2a类致癌物清单中。使用时需要严格控制用量。


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的,...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠...