
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、硫化氢
1、物理性质
H2S是一种具有臭鸡蛋气味的气体,ρH2S>ρ空气,能溶于水。
2、化学性质
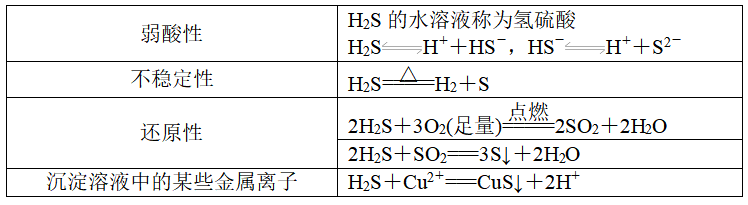
3、实验室制取方法:
FeS+H2SO4===FeSO4+H2S↑。
二、硫及其氧化物的性质
1、自然界中硫元素的存在

2、硫的物理性质
| 俗称 | 颜色状态 | 溶解性 | ||
水 | 酒精 | CS2 | ||
硫黄 | 黄色或淡 黄色固体 | 不溶 | 微溶 | 易溶 |
3、硫的化学性质
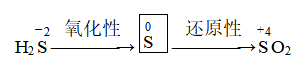
(1)与金属反应:表现氧化性
(2)与非金属反应:既可以表现氧化性,也可以表现还原性
(3)与强氧化剂反应(如浓硫酸):
![]() ,
,
表现还原性。
(4)注意事项
①单质硫燃烧时,产物只能是SO2,无论O2的量是否充足,均不会生成SO3。
②汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理(Hg+S===HgS)。
三、二氧化硫
1、物理性质
颜色 | 气味 | 毒性 | 密度 | 溶解性 |
无色 | 刺激性 | 有毒 | 比空气大 | 易溶于水 |
2、化学性质

填写下列表格:

3、SO2对大气的污染与防治
(1)酸雨的形成过程:
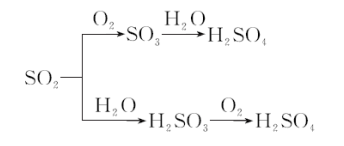
(2)SO2对大气的污染与防治:

①方法一:钙基固硫法
为防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃烧时硫、生石灰、O2共同反应生成硫酸钙,从而使硫转移到煤渣中,反应原理为
![]()
总反应方程式为
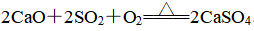
②方法二:氨水脱硫法
该脱硫法采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,其反应的化学方程式为
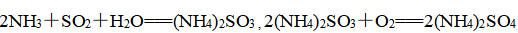
(或生成NH4HSO3,然后进一步氧化)
③方法三:钠碱脱硫法
钠碱脱硫法是用NaOH/Na2CO3吸收烟气中的SO2,得到Na2SO3和NaHSO3,发生反应的化学方程式为
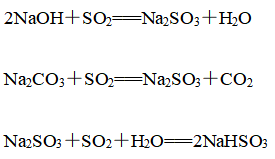
④方法四:双碱脱硫法
先利用烧碱吸收SO2,再利用熟石灰浆液进行再生,再生后的NaOH碱液可循环使用,化学反应原理为
①吸收反应:
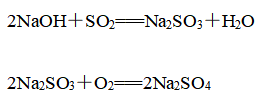
②再生反应:
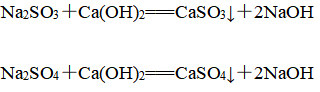
4、二氧化硫的实验室制备
(1)实验原理:
①方法一:
![]()
②方法二:
![]()
(2)实验装置:
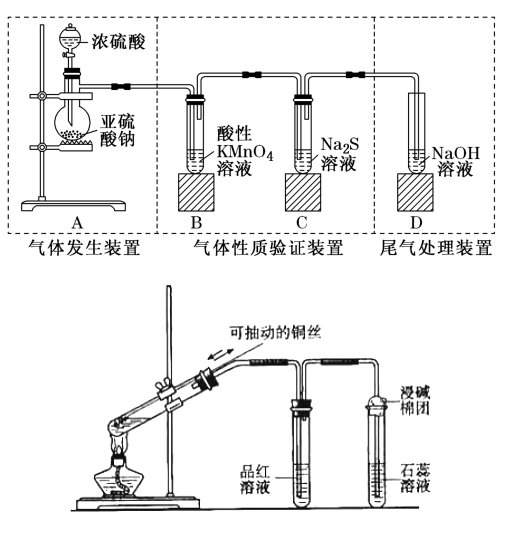
①发生装置:
用分液漏斗、圆底烧瓶组装的固液加热型制气装置
②铜(可抽动铜丝,可随时控制反应发生和停止)与浓硫酸加热
③净化装置:盛有浓硫酸的试管,干燥除水蒸气
④收集方法:向上排空气法或排饱和亚硫酸氢钠溶液法
⑤尾气处理装置:用强碱溶液吸收多于二氧化硫,防止污染空气
(3)性质检验
①漂白性:先通入品红试液,褪色,加热后又恢复原红色
②还原性:
将气体通入稀氯水中,使氯水褪色;
将气体通入稀溴水中,使溴水褪色;
将气体通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色;
将气体通入氯化铁溶液中,氯化铁溶液由黄色变成浅绿色;
将气体通入硝酸钡溶液中,产生沉淀。
⑥氧化性:通入氢硫酸,发生归中反应,产生黄色S沉淀
(4)验满方法:用玻璃棒蘸氨水放在瓶口,如果出现浓厚的白烟,表示二氧化硫已收集满。
(5)实验相关考点
①由于二氧化硫极易溶于水,所以实验室制取二氧化硫的过程中,应用浓硫酸和固体Na2SO4作为反应物,减少二氧化硫的溶解损耗。(浓硫酸浓度为75-85%,不可过浓过稀)
②不可用浓盐酸代替浓硫酸,因为其中含有大量的水(常温常压下,质量分数最大的浓盐酸为45%的浓盐酸),否则会有大量的SO2溶解在水中,使产量减少。
③实验结束后应先排净装置中残留的二氧化硫,再拆除装置,防止残留的二氧化硫进入到空气中,造成污染。
5、二氧化硫的漂白性检验
(1)实验操作及现象
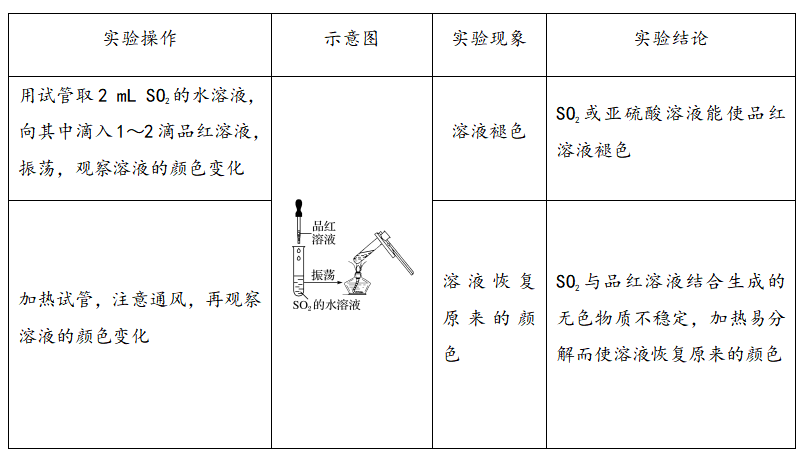
(2)实验相关考点
①SO2的漂白原理:二氧化硫具有漂白作用,能使品红溶液等有色物质褪色。其作用机理是二氧化硫与某些有色物质结合生成了不稳定的无色物质。加热后又显红色,是由于不稳定的无色物质又分解为原来物质的缘故。利用品红溶液可检验SO2气体
②应用:SO2在工业上应用于漂白纸浆、毛、丝等;此外SO2可用于杀菌消毒,还是一种食品添加剂
③SO2虽具有漂白性,但不能漂白指示剂,如:SO2通入紫色的石蕊试液中,溶液只变红不褪色,而氧化类漂白剂(氯水、Na2O2)则能漂白酸碱指示剂
④SO2使溴水、KMnO4溶液褪色,是利用SO2的还原性,而不是漂白性
SO2使品红溶液褪色需要一定时间才能观察到明显现象,可以加一份空白品红溶液作对比,以便于观察比较。
四、三氧化硫
1、物理性质:熔点16.8 ℃,沸点44.8 ℃,在常温下为液态,在标准状况下为固态。
2、化学性质:具有酸性氧化物的通性
反应 | 化学方程式 |
与水反应 | (放出大量的热) |
与氧化钙反应 |
|
与氢氧化钠反应 |
|
使指示剂变色 | 能使紫色石蕊溶液变红 |
五、浓硫酸的性质与应用
1、硫酸的结构
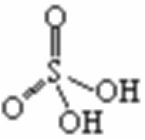
(1)S原子杂化方式:sp3杂化
(2)化学键:含2个配位键,提供孤对电子的是硫原子
(3)SO42-的空间构型:正四面体形
(4)SO42-的等电子体
①分子:SiF4、CCl4、CF4、SiCl4
②阴离子:ClO4-、SO42-、PO43-、SiO44-、BF4-
2、物理性质
(1)色、态:无色黏稠状液体
(2)溶解性:以任意比和水互溶,同硝酸、乙醇
①原因:浓硫酸与水分子之间可以形成氢键
②热效应:溶解时放出大量的热
③稀释:将浓硫酸沿玻璃棒缓慢倒入水中,边加边搅拌
(3)沸点:338℃,具有难挥发性,原因是:浓硫酸中存在分子间氢键
(4)浓度和密度
①常用浓硫酸浓度为98.3%,密度1.84g/cm3,物质的量浓度为18.4mol/L
②浓硫酸中水很少,主要以硫酸分子形式存在
③在写离子方程式时,浓硫酸不能拆写成离子形式,而应该保留化学式形式
④氨气通入浓硫酸的现象是:产生白色沉淀,不能用浓硫酸作为氨气的吸收剂,否则易堵塞导气管
3、浓硫酸与金属单质反应
(1)铝和铁与浓硫酸反应,条件不同,反应不同
①
![]()
(表现强氧化性)
②
![]()
剧烈反应,生成硫酸盐和SO2气体(表现酸性和强氧化性)
(2)
![]()
不反应
(3)氢前的活泼金属(如Zn)与浓硫酸常温反应,先放出SO2气体,后放出H2
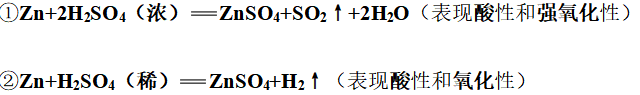
(4)氢后的不活泼金属(如Cu)与浓硫酸加热反应,先放出SO2气体,后反应停止
①化学方程式:
![]()
(表现酸性和强氧化性)
②离子方程式:
![]()
(不能拆)
4、浓硫酸与碳等非金属单质加热反应
(1)过程:

先放CO2和SO2气体,后反应停止
(2)反应:
![]()
(表现强氧化性)
5、浓硫酸与还原性化合物反应:
![]()
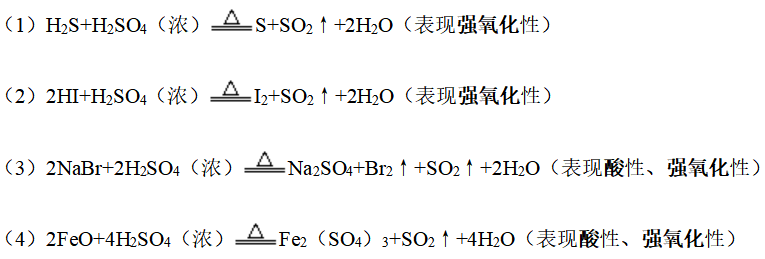
6、浓硫酸的吸水性
(1)含义:吸收自由水或结晶水
(2)变化:化学变化(形成H2SO4·xH2O)
(3)作干燥剂,不能干燥四种气体
①强还原性气体:H2S、HI、HBr
②碱性气体:NH3
(4)浓盐酸和浓硫酸混合制备HCl
①少量:将浓盐酸滴加入浓硫酸中
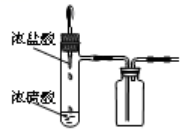
②大量:将浓硫酸加入浓盐酸中
7、浓硫酸的脱水性
(1)含义:将有机物中的H、O元素按2∶1脱去
(2)变化:化学变化
(3)实验现象
①纸张、木材、棉花![]() 变黑
变黑
②湿润的蓝色石蕊试纸先变红后变黑
(4)蔗糖碳化
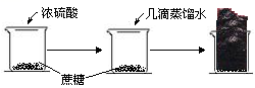
①现象:蔗糖变黑,体积膨胀,产生大量有刺激性气味的酸雾
②反应:
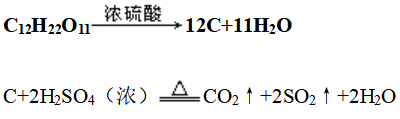
③性质:浓硫酸表现脱水性、吸水性和强氧化性
(5)强腐蚀性
①原理:浓硫酸可以脱去皮肤中的水
②不慎将浓硫酸沾在皮肤上:先用干布蘸去大量硫酸,再用大量清水冲洗,最后涂3%~5%的碳酸氢钠溶液
8、硫酸根离子的检验
(1)常见的干扰反应及排干扰反应或措施

(2)最佳检验流程
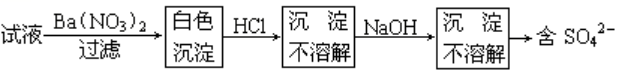
①加入硝酸钡溶液得到的白色沉淀可能是BaCO3、BaSO3、BaSO4、H2SiO3,并且将NO3-留在溶液中
②加入盐酸可以排除BaSO3和BaCO3的干扰,得到的白色沉淀可能是BaSO4、H2SiO3
③加入NaOH溶液可以排除H2SiO3的干扰,得到的白色沉淀是BaSO4
9、硫酸的工业制法

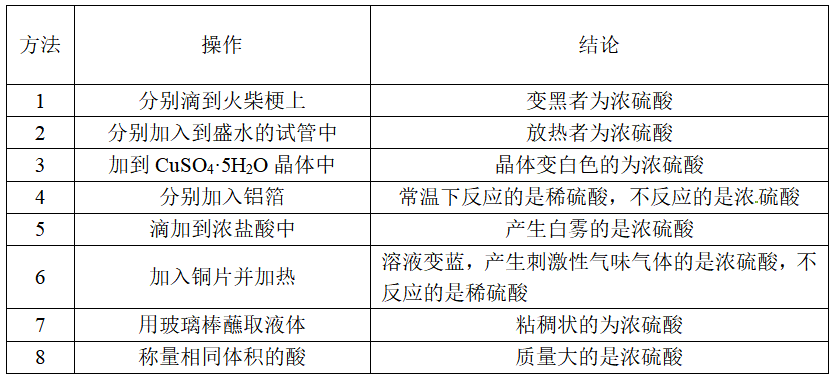
10、鉴别浓硫酸和稀硫酸的方法
六、亚硫酸、亚硫酸盐和硫代硫酸盐
1、亚硫酸的性质
(1)弱酸性:
![]()
①相对强弱:酸性比碳酸的强
②实验验证:饱和NaHCO3溶液中通入足量SO2,将产生的气体先通过足量的酸性高锰酸钾溶液,溶液未完全褪色,再将剩余气体通入澄清石灰水中,溶液变浑浊,则可说明亚硫酸的酸性比碳酸的强
(2)不稳定性:
![]()
(3)强还原性:
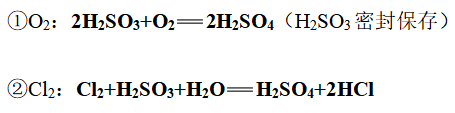
(4)弱氧化性:
![]()
2、亚硫酸钠的性质
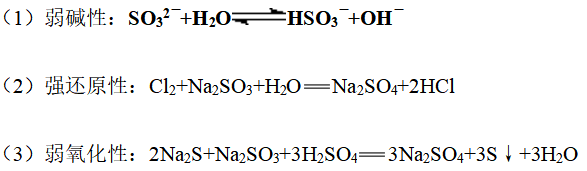
3、亚硫酸钠在空气中变质
(1)变质反应:
![]()
(2)保存方法:密封保存
(3)实验验证:取样→加水溶解→加入足量BaCl2溶液→加入足量盐酸溶液
①完全变质:产生的白色沉淀不溶解
②没有变质:产生的白色沉淀全部溶解
③部分变质:产生的白色沉淀部分溶解
4、硫代硫酸钠的性质
(1)与稀硫酸反应
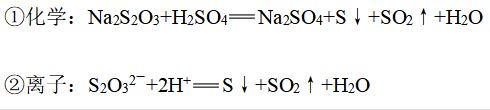
(2)应用:通过测定单位时间内产生沉淀的质量探究外界条件对化学反应速率从影响

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
...
(一)氮气 1. 氮元素的存在 既有游离态又有化合态。它以双原...
...
...
氯化硫介绍 氯化硫(即二氯化二硫),有特殊气味。在空气中发...