
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
NH3与氨水比较
氨气溶于水时与水反应,生成不稳定的一水合氨(弱碱)
NH3+H2O⇋NH3·H2O
NH3·H2O⇋NH4++ OHˉ
NH3·H2O  NH3↑+ H2O
NH3↑+ H2O
氨气溶于水得到的溶液叫做氨水,溶质主要为氨分子、一水合氨分子和一水合氨电离出的铵根离子、氢氧根离子;氨水呈弱碱性,可使指示剂变色。
注意:氨水不等同于一水合氨。氨水是溶液(混合物),一水合氨是溶质。氨气液化后得到的液氨是纯净物。
1.NH3的分子结构
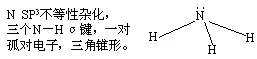
2.液氨的性质(和H2O相比较):-33.4℃液化,可作非水溶剂。它是路易斯碱。
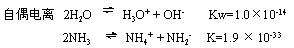
故液氨和H2O一样,很难电离;
和Na反应,H2O和Na反应迅速,NH3和Na反应极慢,放置时反应如下:
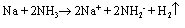
H2逸出后,蒸干得白色固体NaNH2,即氨基钠。
NH3(l)能溶解碱金属,稀溶液显蓝色。
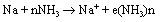
氨合电子是金属液氨溶液显蓝色的原因,也是金属液氨溶液显强的还原性和导电性的依据。它的导电性超过任何电解质溶液,类似金属。
3.氨的化学性质
a)络合反应
氨分子中有一个孤电子对,所以可与许多金属离子配位形成络离子。
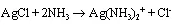
B:2s22p1→sp2杂化,与3个F形成三个键,B中还有一个空的2p轨道,NH3的孤电子对填到B的2p空轨道中。
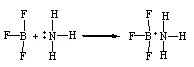
NH3溶于水中形成水合氨分子,NH3·H2O,而不是NH4OH,氨分子是通过氢键与水结合成NH3·H2O。
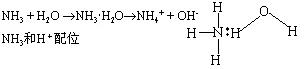
上述这些反应归于氨分子中存在孤电子对,氨起路易斯碱的作用。
b)还原性
NH3中N(-3价)只能作还原剂,在氧气中燃烧生成N2+H2O,Pt催化时产物是NO和H2O,氯和溴也能将NH3氧化。

高温下氨的还原性增强
氨气还原CuO
c)取代反应
NH3中的H可依次被取代,生成-NH2(氨基)、(亚氨基)和氮化物的衍生物。
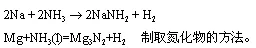
非金属也可以发生取代。
NH4Cl + 3Cl2→ 4HCl + NCl3(黄色油状液体)
NCl3受振动或受热90℃以上猛烈爆炸分解
2NCl3→N2+3Cl2
因为Cl作配体半径大,配体间斥力大,所以不稳定。
而NF3却是相当稳定的无色液体。因为F半径小,彼此之间斥力小,所以可稳定存在。
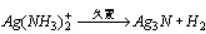
久置的银氨溶液可以析出叠氮化银(AgN3)、氮化银(Ag3N)、亚氨基化银(Ag2NH)三种沉淀,叠氮化银非常不稳定,很容易爆炸的。
d)氨解反应
氨基,亚氨基,可取代其它化合物的原子或基团
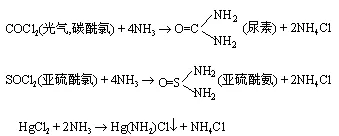
氨解反应和水解类似。
4.检验
NH3--湿润的红色石蕊试纸变蓝;蘸有浓盐酸的玻璃棒靠近气体有白烟生成。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
磷作为周期表第 ⅤA 族核心元素,兼具 “生命不可替代性”(构...
硫酸盐 俗名 颜色 用途 2CaSO 4 H 2 O 熟石膏 白色 CaSO 4 2H 2 O 生石膏...
...
1.在二元化合物中,如果电正性的金属元素仅出现两种氧化态时...
合金的熔点一定低于各成分金属吗?教材只是说合金的硬度、熔...
金属锌与硝酸的反应,是一个非常经典的化学反应问题。金属锌...