
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、为什么SO2溶解实验时,往往需要不断摇晃试管液面才能上升?
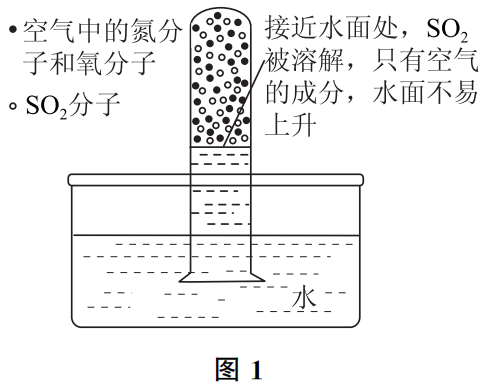
如图1所示,在试管中用排空气法收集SO2,用拇指堵住管口,将其移至水槽中,移开拇指,观察SO2在水中的溶解情况。此实验会因操作不同,产生很多种不同情况,有时候一松开拇指,水会“蹭”地一下“窜”进试管,且几乎完全充满了整个试管;而有时水面上升得很慢,需要“不停地摇晃试管”,水柱才会缓慢上升,且最终水柱不会升到试管顶端.显然,前者SO2气体收集得比较满;而后者试管里混有空气,那么,为什么需要“不停地摇晃试管”才能使水柱上升呢?
当SO2中混有空气时,虽然气体分子会不断扩散,但毕竟其扩散速率有限(事实证明如此),虽然SO2易溶于水,但它的分子并不会“主动跑到水里”去,只有它与水面接触时,才会发生溶解过程.把混有空气的SO2扣在水里时,当与水面接近的SO2分子被溶解后,与水面接触的就只有空气了,由于空气在水中溶解量小且溶解速率慢,气体的体积短时间内不再减小,水面就不会持续上升。若晃动试管,促进气体分子扩散,则可使部分SO2分子再与水面接触而溶解,水面才能持续上升。
不仅SO2,其他可溶性气体如NH3、HCl、NO2等的溶解性实验中,也常常发生上述现象,所以我们要学会从微粒运动的角度加以分析。
2、SO2是形成酸雨的罪魁祸首,为什么酸雨中不含亚硫酸而是硫酸?
首先,请大家不要妄想酸雨里会含有亚硫酸,因为全球各地的酸雨研究者都没有在酸雨里检出过亚硫酸。尽管有些命题人凭自己的想象,常常假设酸雨里含有亚硫酸,但那只是不合实际的想象。大多数酸雨专家认为,酸雨里主要含有H2SO4、HNO3这2种酸。酸雨其实早在有人类活动的史前时期就存在,主要是由火山活动喷发出含硫气体在空气中氧化(形成硫酸),以及雷电引发N2、O2化合(最终形成HNO3)所导致的。人类工业革命开始后,短时期(近一二百年)内迅速地把大量地下化石燃料开采出来烧掉,使大气中硫、氮元素的含量急剧上升,酸雨现象更加普遍而已。
大气中SO2的氧化有2条途径:一是溶解于水形成H2SO3后,在水溶液里被溶解的氧分子氧化为H2SO4,从酸雨里不存在亚硫酸这个事实看,该氧化过程应该是比较迅速的,从一些模拟实验的结果看,大概几小时即告完成;二是SO2被大气中的一些飘尘吸附,在飘尘的表面进行氧化,该过程中,吸附SO2的飘尘实际充当了催化剂的角色,很可能H2O也直接参与了氧化反应:
2SO2+O2+2H2O![]() 2H2SO4.
2H2SO4.
3、既然SO2漂白作用不稳定,为什么还用它做漂白剂?
SO2用于草帽、坐垫等草编、纸质的民间工艺品的漂白,首先是出于传统习惯,因为硫磺和SO2是人类早期就认识并掌握其用途的化学物质;其次,SO2的使用相对来说操作简单,一般人经过简单学习即可掌握,特别是SO2有刺激性气味,不会像一些无色、无味的有毒漂白剂那样使人不知不觉中因使用过量而中毒。从商品的实用角度考虑,可能还有一个原因,那就是这些物品的使用寿命往往较短,在SO2的漂白效果尚未丧失之前,物品的使用寿命即告结束,比如草帽,它还没有到回复原色前,就已经破掉了。
4、SO2是否可用作食品添加剂?
SO2被作为食品添加剂是古老的传统,它的作用广泛,如漂白和杀菌(干果、米粉和粉丝、腐竹、白糖、干制食用菌等)、抗氧化(如葡萄酒等果酒)等,所以在生活中常常在葡萄酒包装上看到“配料:葡萄汁、二氧化硫”等字样,给白糖加热、用开水烫粉丝时常常闻到从中逸出的气体具有SO2特有的刺激性气味。
SO2属于有毒物质,长期、过量摄入人体会对肝肾功能造成损害。近年来,随着人们对食品安全的关注度增强,加之一些缺少科学观念的新闻媒体人的恶意或者善意的炒作,使很多人对SO2用于食品加工和保存产生了怀疑,甚至采取否定一切的态度—错误地认为凡是含有SO2的食品都是有害的。
在现代化的工业社会里,“没有食品添加剂就谈不上食品安全”,从“GB2760—2011食品添加剂使用标准查询系统可以查得,二氧化硫、焦亚硫酸钾、焦亚硫酸钠、亚硫酸钠、亚硫酸氢钠、低亚硫酸钠等一系列含硫化合物(多种含硫化合物使用中都会产生SO2,这些化合物用于食品所起的作用也都与直接使用SO2的效果相近,只是它们都是固体,比直接使用SO2方便、易控制使用量)都被允许作为食品添加剂使用,可用于水果、蔬菜、干果、粉丝、腐竹、食用菌干品、果酒类等很多食品,只是不同食品允许的SO2最大残留量不同。
当然,社会公众对SO2用于食品的关注也是有起因的,那就是个别不法分子对SO2类食品添加剂的滥用,如把它违规用于不该添加SO2的食品超量使用等,对此类现象需要执法部门加强检查和监管。
5、SO2与CO2有哪些异同点?
从酸碱反应的视角看,SO2和CO2都是气态酸性氧化物,它们对应的酸都是二元酸,所以SO2与CO2 在和碱反应时显示出极其相似的化学性质,比如与烧碱溶液反应,会因酸碱比例不同形成正盐、酸式盐:
SO2+2OH- =SO32-+H2O(SO2不足),
SO2+OH-=HSO3-(SO2过量),
CO2+2OH =CO32-+H2O(CO2不足),
CO2+OH =HCO3-(CO2过量).
通入石灰水时,都可以先形成白色沉淀,气体过量时则因形成溶解度大的酸式盐而致沉淀溶解:
SO2+Ca2++2OH- =CaSO3↓+H2O,
CaSO3+SO2+H2O = Ca2++2HSO3-,
CO2+Ca2++2OH- =CaCO3↓+H2O,
CaCO3+CO2+H2O = Ca2++2HCO3-
不同的是,SO2对应的酸亚硫酸(Ka1 = 1.3 ×10-2,Ka2=6. 3×10-8)为中强酸,而CO2对应的碳酸 (Ka1=4. 2×10-7, Ka2= 5. 6×10 -11)为弱酸,前者可以把后者从其盐溶液中置换出来:
2SO2+CO32-+H2O = 2HSO3-+CO2,
SO2+HCO3- = HSO3-+CO2
所以可利用饱和NaHCO3溶液除去混在CO2气 体中的SO2气体.
(思考:NaHSO3能不能与NaHCO3溶液反应放 出CO2呢? H2CO3能不能与Na2SO3溶液反应将其 转化为NaHSO3呢?请根据二者的电离平衡常数作出判断。)
从氧化还原的视角来看,2种气体都具有弱的氧化性,如:
SO2+2H2S=3S↓+2H2O,
CO2+2Mg  2MgO + C,
2MgO + C,
CO2+C 2CO
2CO
但是二者的还原性差异很大,SO2具有强的还 原性:
SO2+I2+2H2O = SO42-+2I-+4H+

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
磷作为周期表第 ⅤA 族核心元素,兼具 “生命不可替代性”(构...
硫酸盐 俗名 颜色 用途 2CaSO 4 H 2 O 熟石膏 白色 CaSO 4 2H 2 O 生石膏...
...
1.在二元化合物中,如果电正性的金属元素仅出现两种氧化态时...
合金的熔点一定低于各成分金属吗?教材只是说合金的硬度、熔...
金属锌与硝酸的反应,是一个非常经典的化学反应问题。金属锌...