
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
绝热体系就是体系与环境之间没有热量传递"对于一个化学反应,当平衡还未建立或者平衡发生移动的时候,反应总要放出或吸收热量,温度会随之升高或降低,从而对反应本身或对其他共存的反应带来影响。
近几年高考中,频繁出现绝热体系中的化学平衡问题,成为一大难点,常见题型有以下三类:
一、绝热体系中化学平衡状态的判断
绝热体系中的温度取决于反应的热效应,当反应达到平衡状态时,正逆反应吸收或放出的热量相等,体系的温度就不再改变"也就是说,对于绝热体系,当体系温度一定时,则标志化学反应达到平衡状态。
例 1: 汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g),该反应的ΔH<0,若该反应在绝热!恒容的密闭体系中进行,图 1 所示正确且能说明反应在进行到t1时刻达到平衡状态的是 ( 填代号)
2CO2(g)+N2(g),该反应的ΔH<0,若该反应在绝热!恒容的密闭体系中进行,图 1 所示正确且能说明反应在进行到t1时刻达到平衡状态的是 ( 填代号)
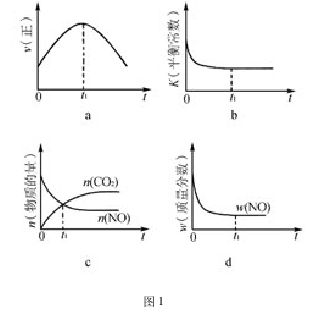
解析 本题考查的是判断平衡状态的标志若在恒温!恒容条件下,图 1 中变量保持不变时,均可判断反应达平衡"在绝热!恒容条件下,反应只受温度影响,由于达平衡时体系温度不再改变,所以以上的四个变量也不会随时间发生改变"故粗略即可判断 b、d中t1符合题意"
对于a 图像的分析: 随着反应的进行,反应物浓度逐渐减小,正反应放热,体系温度升高"这两个因素对 ν( 正) 的影响正好相反,若体系温度升高对正反应速率的影响占主要,则 ν( 正) 逐渐增大"在t1时刻,ν( 正) 达最大,接着 ν( 正) 又逐渐减小,说明反应物浓度降低对正反应速率的影响占主要,所以图像 a 的趋势是合理的"只是t1时刻正反应速率仍在变化,未达到平衡状态,所以 a错误。
对于 b,由于正反应放热,随反应的进行,体系温度升高,平衡常数逐渐降低,在t1时刻不再改变,因此t1时刻反应达到平衡状态,所以 b正确。
对于 c 和 d,不论该正反应是吸热反应还是放热反应,在达平衡前,均是向正反应方向进行。所以,反应物的物质的量逐渐减少,生成物的物质的量逐渐增加,并且反应物的质量分数逐渐减小。c 和 d 的变化趋势正确,只是 c 中t1时刻仅指 CO2和 NO 的物质的量相等,不是判断平衡状态的标志。因此 c错误,d 正确。
本题最困扰学生的是绝热体系的温度改变和外界环境的温度改变的区别,只要抓住了绝热体系的温度是体系内部产生的,反应达平衡时,温度就不再改变,各变量也就保持不变; 而外界环境的温度改变,将使平衡状态只能维持在一个瞬间。
二、绝热体系中化学平衡移动的分析
例 2: 在一个不导热的密闭反应器中,只发生两个反应:
a( g) +b( g )  2c( g) ΔH<0 (1)
2c( g) ΔH<0 (1)
x( g) + 3y( g )  2z( g) ΔH>0 (2)
2z( g) ΔH>0 (2)
进行相关操作且达到平衡后( 忽略体积改变所做的功) ,下列叙述错误的是( )
A.等压时,通入惰性气体,) 的物质的量不变
B.等压时,通入 - 气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入 z 气体,y 的物质的量浓度增大
解析: 这题主要考查平衡移动,“不导热的密闭反应器”,即为绝热体系,首先,分析两个反应的特点,反应( 1) 为放热反应,特点是化学方程式两边气体前系数和相等,故压强改变不能引起平衡移动;反应( 2) 为吸热反应,化学方程式两边气体前系数和不等,压强改变会引起平衡移动。
选项 A: 由于条件是等压,通入惰性气体,对整个体系的作用是增大了容器体积,使得反应物和生成物的物质的量浓度等倍数减小( 相当于减压) "压强减小使反应( 2) 的平衡向逆反应方向移动,由于逆反应是放热反应,体系温度升高"而温度升高又引起了反应( 1) 的平衡向逆反应方向移动,因此 c 的物质的量减少。所以选项 A 错误
选项B : 等压条件下通入 z 气体,对反应( 2)而言,平衡逆向移动,放出热量,反应容器温度升高,选项 B 正确.
选项C ,: 等容条件相对要简单些,通入惰性气体,对于两反应的反应物和生成物的物质的量浓度没有改变,因此不能改变两反应速率,平衡不会发生移动,也不会带来温度的改变,选项 C正确
选项D: 等容条件下通入 z气体,对反应( 2)而言,增加了z的物质的量浓度,平衡向逆反应方向移动,y 的物质的量浓度增大,选项 D 正确
本题型是两个反应的相互影响,压强对第一个反应没有影响,根据第二反应的移动热效应,判断第一个反应的移动"但是根据勒沙特列原理,平衡将向着“减弱”外界条件变化的方向移动,也就是对第一个反应受温度改变,平衡发生移动后,最终体系的温度改变仍然是由第二个反应引起的
三、绝热体系中“等效平衡”的演变
例 3: 一定条件下存在反应:CO( g) +H2O( g )  CO2( g) +H2( g) ,其正反应放热。现有三个相同的2L恒容绝热( 与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO 和 1mol H2O,在Ⅱ中充入1mol CO2和 1molH2
CO2( g) +H2( g) ,其正反应放热。现有三个相同的2L恒容绝热( 与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO 和 1mol H2O,在Ⅱ中充入1mol CO2和 1molH2
,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃ 条件下开始反应达到平衡时,下列说法正确的是( )
A. 容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ 的物质的量比容器Ⅱ中的多
D.容器ⅠCO的转化率与容器Ⅱ中CO2的转化率之和小于1
解析: 这题所给条件若是恒温、恒容,则为一道非常容易的题。体系恒温,平衡常数相同。而容器Ⅰ、Ⅱ、Ⅲ中反应均等效,其中容器Ⅰ、Ⅱ分别从反应物和生成物投料,达到平衡状态时各组分物质的量均相等,并且容器Ⅰ中 CO的转化率与容器Ⅱ中CO2的转化率之和等于1。容器Ⅲ中投料是容器 Ⅰ、Ⅱ中的两倍,达平衡时,各组分物质的量是容器Ⅰ、Ⅱ的两倍。
但是,在绝热体系中,容器Ⅰ从正反应开始,正反应放热,体系温度升高; 而容器Ⅱ从逆反应开始,逆反应吸热,体系温度降低。由于 T(Ⅰ) >T( Ⅱ) ,所以容器Ⅰ中正反应速率要大于容器 Ⅱ中,所以选项 A错误。
由于容器Ⅰ中反应放热,体系温度升高,使得平衡向逆反应方向移动,CO的转化率减小,CO 的物质的量增多; 而容器Ⅱ中吸热,体系温度降低,使得平衡向放热反应方向移动,CO2的转化率减小,CO的物质的量减少。所以,容器Ⅰ中CO 的物质的量比容器Ⅱ中的多,选项C 正确。容器Ⅰ中 co 的转化率与容器Ⅱ中co2的转化率之和小于1,所以选项 D正确。
容器)Ⅰ、Ⅲ同为反应物投料,容器Ⅲ中反应物的物质的量是容器Ⅰ中的两倍,所以容器Ⅲ中反应放出热量多,体系温度高,容器Ⅰ、Ⅲ中反应的平衡常数不同,选项 B 错误。
本题型的特点是建立在“等效平衡”的基础上,先分析恒温条件下等效平衡的情况,再结合体系温度改变,平衡发生移动,带来其他量的变化,这样思路就明确多了。
绝热体系类型的题,其实紧紧抓住温度的变化,就能化难为易"任何反应进行或平衡移动时必将引起热量的变化,从而导致温度发生改变。温度变化对反应本身有影响,对同一体系中的其他反应也有影响"但一旦反应达到平衡状态,温度将不再改变,各变量也将保持不变。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
一、公式提出的背景 19世纪末,化学家们逐渐意识到温度对化学...
假设对于反应 a A(g) + b B(g) g G(g) + h H(g) 中各物质均为理想气体,...
例:某温度、起始压强为100 kPa下,若将2mol SO 2 和1molO 2 ,通入恒...
...
什么是活化能、能垒? 1 、能垒 活化分子含有的能参加化学反应...