
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
例题:有两个密闭容器A和B,A容器有一个移动的活塞能使容器保持恒压,B容器能保持恒容。起始 时,向这两个容器中分别充入等童的体积比为2 : 1的 SO2和O2的混合气体,并使A和B容积相等。在保持 400°C的条件下,使之发生如下反应2SO2+O2 2SO3, 请填空:
2SO3, 请填空:
①达平衡时所需要的时间,A容器比B容器化学 平衡 。A容器中SO2的转化率比B容器中 。
②平衡后,A容器中混合气体的平均分子量比B 容器的
③达平衡后,若向两容器中通入等量的惰性气体氩,A容器中化学平衡 移动;B容器中 移动。
④达①所述的平衡后,若向两容器中通入等量的 体积比为2 :1的SO2和O2的混合气体,达到平衡时, A容器中SO3的百分含量 ,B容器中SO3的百分含量 (填增大、减小、不变)。
评注:许多同学遇到此类题时思维混乱,感到无从 下手,往往费时费力,得出的结果却与正确答案相反。 现介绍解此类題的技巧,供参考。
(1)对于反应后气体总体积减小的反应,恒温恒压的容器的平衡状态与恒温恒容的容器的平衡状态相比 较,前者可看作是增大压强,化学平衡向气体体积减小 的方向移动,反应速率比后者快。具体分析过程如下:
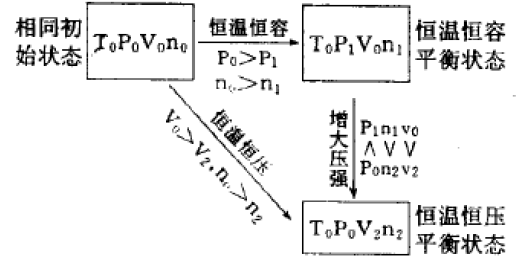
由上图分析可知:恒温恒压平衡状态相当于由恒温恒容平衡状态增大压强而得,因此恒温恒压容器中的平衡向气体体积减小的方向移动。由于容器体积减 小,相当于增大反应物浓度,所以恒温恒压容器里的反 应速率比恒温恒容的快。
(2)对于反应后气体总体积增大的反应,恒温恒压 的容器里的平衡状态与恒温恒容的容器里的平衡状态 相比较,前者可看作是减小压强,平衡向气体总体积梢 大的方向移动,反应速率比在恒温恒容的容器里的慢。
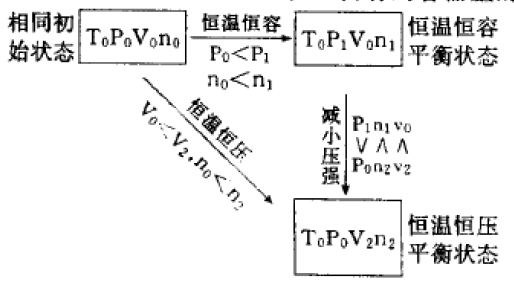
具体分析过程类似(1)。
(3) 对反应前后气体体积保持不变的反应,两容器内的反应能达到相同的平衡状态。
(4) 在已达到化学平衡的反应容器中,再加入与原配比相同的反应物时,恒温恒压的容器相当于加入的物质在另一容器中达到了相同的平衡状态;恒温恒容 的容器相当于增大压强,化学平衡向气体体积减小的方向移动。
解析:2SO2 + O2  2SO3是气体总体积减小的反应。
2SO3是气体总体积减小的反应。
①由上述解法可知:A与B容器相比较,相当于增大压强,A容器中反应速率大,达平衡所需的时间一定 比B的少。平衡后A容器中SO2的转化率一定比B的 大。
②达平衡后,A容器中混合气体的物质的童比B 容器中少,而两容器中气体质摄相等,所以A容器中混 合气体的平均分子量比B中的大。
③达平衡后再充入氩气,A容器体积增大,相当于减小压强,化学平衡向逆反应方向移动。B容器中各反 应物、生成物浓度保持不变,所以B容器中平衡不移 动。
④达到①所述的平衡后,再充入与原配比相同的反应物时,A容器中相当于充入的反应气体在另一容器中达到了与A容器中相同的平衡状态,所以A容器 中SO3的百分含童保持不变。B容器中相当于增大压强,化学平衡向正反应方向移动,SO3的百分含虽增 大。
练习:(1)在A、B两个密闭容器中,A能保持恒温 恒容,B能保持恒温恒压,把质量相等的N2O4气体分 别放入A、B中,并使初始A、B容积相等.请填写下列空白:
①开始时两容器中NO2的生成速率分别为VA、VB,则二者关系是_____ (用=、<、>表示,以下同),反应过程中VA__________ VB
②平衡后两容器中N2O4的分解率分别为XA、XB, 则 XA XB。
③平衡后两容器中混合气体的密度分别用DA、DB 表不,则DA DB。
④达①平衡后两容器中再充入等量的N2O4,则A 容器中N2O4的百分含量 ,B容器中N2O4的百分含量 (填增大、减小、不变)。
(2)若把(1)题中的N2O4换成以等体积混和的氢气和碘蒸气,情况又会怎样?
参考答案:
(1) 题①=,>1;②< ;③>;④增大,不变,
(2) 题①=,= ;②=;③=;④不变,不变。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
一、公式提出的背景 19世纪末,化学家们逐渐意识到温度对化学...
假设对于反应 a A(g) + b B(g) g G(g) + h H(g) 中各物质均为理想气体,...
例:某温度、起始压强为100 kPa下,若将2mol SO 2 和1molO 2 ,通入恒...
...
什么是活化能、能垒? 1 、能垒 活化分子含有的能参加化学反应...