
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] 通过计算比较硫化钠和氯化铵溶液中的离子浓度大小 作者:化学自习室 来源:未知 日期:2025-07-08 17:16:51 点击:276 所属专题:离子浓度大小比较
[注解与辨疑j] 通过计算比较硫化钠和氯化铵溶液中的离子浓度大小 作者:化学自习室 来源:未知 日期:2025-07-08 17:16:51 点击:276 所属专题:离子浓度大小比较
1、通过计算比较Na 2 S溶液中的离子浓度大小 2、通过计算比较NH 4 Cl溶液中的离子浓度大小 3、总结 两种盐溶液水解程度不同,引起离子浓度不同。Na 2 S溶液中S 2- 水解程度大,不可忽略,S2-的水解一方面促进了水的电离使c(OH - )增大,另一方面使自身离子浓度变小,造...
 [注解与辨疑j] 溶度积大,溶解度就大吗? 作者:化学自习室 来源:未知 日期:2025-07-08 17:01:23 点击:322 所属专题:溶度积与溶解度
[注解与辨疑j] 溶度积大,溶解度就大吗? 作者:化学自习室 来源:未知 日期:2025-07-08 17:01:23 点击:322 所属专题:溶度积与溶解度
溶解度和溶度积换算 溶解度和溶度积均可以定量表示难溶物质的溶解性。 溶解度与溶度积之间的换算,关键在于找出难溶性强电解质溶解得到的离子浓度与溶解度之间的关系。 1、已知溶度积求溶解度 2、已知溶解度求溶度积 3、总结: 4、提问: 5、再次总结: 所以我们在比较...
 [注解与辨疑j] 用平衡常数定量解决化学疑难问题 作者:化学自习室 来源:未知 日期:2025-07-02 18:30:41 点击:156 所属专题:化学平衡常数
[注解与辨疑j] 用平衡常数定量解决化学疑难问题 作者:化学自习室 来源:未知 日期:2025-07-02 18:30:41 点击:156 所属专题:化学平衡常数
...
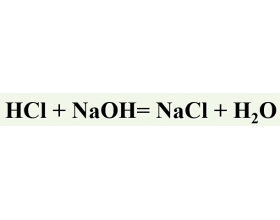 [注解与辨疑j] 常考滴定反应及其方程式 作者:化学自习室 来源:未知 日期:2025-05-19 14:46:36 点击:338 所属专题:滴定法
[注解与辨疑j] 常考滴定反应及其方程式 作者:化学自习室 来源:未知 日期:2025-05-19 14:46:36 点击:338 所属专题:滴定法
酸碱滴定法 强酸滴定强碱的反应 强酸滴定弱碱的反应 混合碱的滴定(双指示剂法+滴定突跃个数的判断) 强碱滴定强酸的反应 强碱滴定弱酸的反应(食品中乙酸含量的测定) 强碱滴定多元酸的反应(分步滴定+滴定突跃个数的判断) HCl标准溶液的标定(基准物质+待标定液) Na...
 [注解与辨疑j] 不同类型的沉淀,一定无法比较Ksp的大小关系? 作者:化学自习室 来源:未知 日期:2025-04-23 08:21:53 点击:604 所属专题:沉淀转化
[注解与辨疑j] 不同类型的沉淀,一定无法比较Ksp的大小关系? 作者:化学自习室 来源:未知 日期:2025-04-23 08:21:53 点击:604 所属专题:沉淀转化
【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 Fe(OH) 3 ,这两个实验能不能说明沉淀的Ksp大小关系呢? 因为沉淀类型不同,所以还是无法比较二者的 Ksp吗? 【释疑】 首先,我们一起来回顾一下教材是如何说明Ksp(AgCl)大于Ksp(AgI)...
 [注解与辨疑j] 水的浓度是多少? 作者:化学自习室 来源:未知 日期:2025-03-10 08:36:53 点击:1830 所属专题:水的电离
[注解与辨疑j] 水的浓度是多少? 作者:化学自习室 来源:未知 日期:2025-03-10 08:36:53 点击:1830 所属专题:水的电离
水的“浓度”需要根据具体的使用情况来理解,具体有如下几种情况: 第一:若按液态纯水的物质的量浓度计算,约为55.56m。 第二:若指水中H + 或OH的浓度(25℃),则为1.0×10M。 第三:在化学反应中,水的浓度通常视为恒定,不显式参与平衡表达式。 第四:若溶质浓度较...
 [注解与辨疑j] 实例说明盐类的水解都是微弱的吗? 作者:化学自习室 来源:未知 日期:2025-01-19 18:01:41 点击:362 所属专题:盐类水解规律
[注解与辨疑j] 实例说明盐类的水解都是微弱的吗? 作者:化学自习室 来源:未知 日期:2025-01-19 18:01:41 点击:362 所属专题:盐类水解规律
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育出版社《无机化学》(第五版)上册 333-334 页)。 S 2 的水解分两步进行: S 2 + H 2 O HS +OH , HS + H 2 O H 2 S + OH 。 由于第一步水解的程度远远大于第二步水解,因此下面计算...
 [注解与辨疑j] 沉淀转化中的一类问题 作者:化学自习室 来源:未知 日期:2024-12-24 08:13:32 点击:1154 所属专题:沉淀转化
[注解与辨疑j] 沉淀转化中的一类问题 作者:化学自习室 来源:未知 日期:2024-12-24 08:13:32 点击:1154 所属专题:沉淀转化
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类问题,学生们往往容易理解和接受。因为我们说,离子反应发生条件就是“离子浓度大变...
 [注解与辨疑j] 酸碱中和滴定曲线几个关键点分析 作者:化学自习室 来源:未知 日期:2024-09-22 14:19:30 点击:502 所属专题:中和滴定曲线
[注解与辨疑j] 酸碱中和滴定曲线几个关键点分析 作者:化学自习室 来源:未知 日期:2024-09-22 14:19:30 点击:502 所属专题:中和滴定曲线
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3 COOH溶液所得滴定曲线如图: 2.pH— V (图) (1)各特殊点粒子大小关系及变化趋势 (2)各特殊点对水电离程度的影响 [例] 常温下,用0.05 mol·L -1 NaOH溶液分别滴定10.00 mL 浓度均为...
 [注解与辨疑j] pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明 作者:化学自习室 来源:未知 日期:2024-08-20 16:09:24 点击:524 所属专题:ph计算
[注解与辨疑j] pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明 作者:化学自习室 来源:未知 日期:2024-08-20 16:09:24 点击:524 所属专题:ph计算
问题呈现:pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明。 错解:由pH=5,知 c (H + )=10 -5 mol/L, 加水冲稀1000倍后, 由盐酸产生的 c (H + )=10 -8 mol/L, 由水产生的 c (H + )=10 -7 mol/L, 所以溶液总的 c (H + )=10 -8 mol/L + 10 -7 m...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
什么是“软硬酸碱理论”,1963 年,拉尔夫・皮尔逊提出软硬酸...
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子...