
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.实例
常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1CH3COOH溶液所得滴定曲线如图:
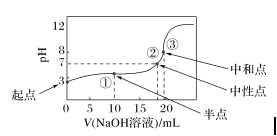
2.pH—V(图)
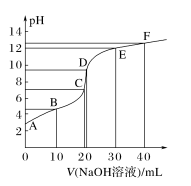
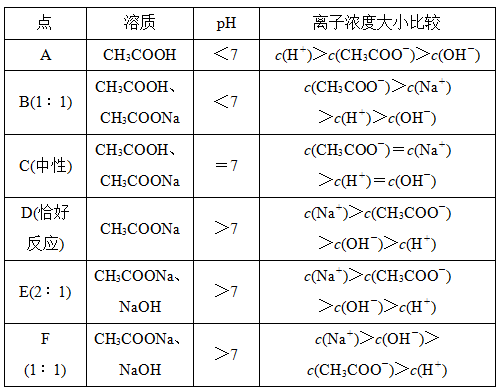
(1)各特殊点粒子大小关系及变化趋势
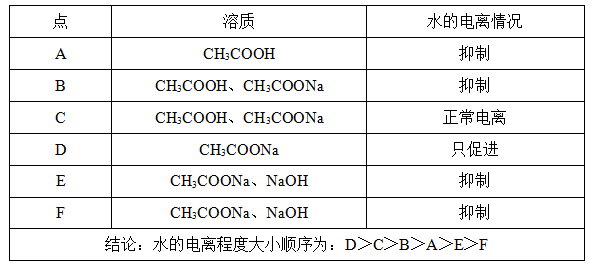
(2)各特殊点对水电离程度的影响
[例] 常温下,用0.05 mol·L-1NaOH溶液分别滴定10.00 mL 浓度均为0.10 mol·L-1的CH3COOH(Ka=1×10-5)溶液和HCN(Ka=5×10-10)溶液,所得滴定曲线如图。下列说法正确的是( )

A.①所标曲线为NaOH滴定HCN,两种弱酸滴定均可选用甲基橙作指示剂
B.溶液中水的电离程度:②>③>④
C.③处溶液有c(Na+)=c(CH3COO-)<c(CH3COOH)
D.点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
答案 D
解析 A.两种酸浓度相同,由于HCN酸性更弱,故其pH更大,①所标曲线为NaOH滴定HCN,恰好反应生成NaCN,显碱性,由于甲基橙的变色范围是pH在3.1到4.4之间,因此滴定HCN时,不宜用甲基橙作为指示剂,A错误;
B.②处溶液pH<7,溶液呈酸性,醋酸电离为主,抑制水的电离,③处溶液pH=7,此时存在CH3COONa和少量的CH3COOH,④处为滴定终点,溶液中恰好生成CH3COONa,CH3COONa水解促进水的电离,因此溶液中水的电离程度:②<③<④,B错误;
C.③处溶液的pH=7,溶液呈中性,溶液中c(H+)=C(OH-),对于所滴定的醋酸溶液,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于C(H+)=c(OH-),则c(Na+)=c(CH3COO-),此时滴加NaOH的体积不到20 mL,因此溶液中还存在极少量的CH3COOH,则浓度关系应为c(Na+)=c(CH3COO-)>C(CH3COOH),C错误;
D.点②的溶液中存在等物质的量的CH3COONa和CH3COOH,根据元素质量守恒,c(CH3COO-)+c(CH3COOH)=0.05 mol·L-1,点①溶液中存在等物质的量的NaCN和HCN,根据元素质量守恒,c(HCN)+c(CN-)=0.05 mol·L-1,两溶液混合,则有c(CH3COO-)+c(CH3COOH)=c(HCN)+c(CN-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),故D正确。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
什么是“软硬酸碱理论”,1963 年,拉尔夫・皮尔逊提出软硬酸...
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...