
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] 实例说明盐类的水解都是微弱的吗? 作者:化学自习室 来源:未知 日期:2025-01-19 18:01:41 点击:336 所属专题:盐类水解规律
[注解与辨疑j] 实例说明盐类的水解都是微弱的吗? 作者:化学自习室 来源:未知 日期:2025-01-19 18:01:41 点击:336 所属专题:盐类水解规律
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育出版社《无机化学》(第五版)上册 333-334 页)。 S 2 的水解分两步进行: S 2 + H 2 O HS +OH , HS + H 2 O H 2 S + OH 。 由于第一步水解的程度远远大于第二步水解,因此下面计算...
 [注解与辨疑j] 沉淀转化中的一类问题 作者:化学自习室 来源:未知 日期:2024-12-24 08:13:32 点击:999 所属专题:沉淀转化
[注解与辨疑j] 沉淀转化中的一类问题 作者:化学自习室 来源:未知 日期:2024-12-24 08:13:32 点击:999 所属专题:沉淀转化
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类问题,学生们往往容易理解和接受。因为我们说,离子反应发生条件就是“离子浓度大变...
 [注解与辨疑j] 酸碱中和滴定曲线几个关键点分析 作者:化学自习室 来源:未知 日期:2024-09-22 14:19:30 点击:454 所属专题:中和滴定曲线
[注解与辨疑j] 酸碱中和滴定曲线几个关键点分析 作者:化学自习室 来源:未知 日期:2024-09-22 14:19:30 点击:454 所属专题:中和滴定曲线
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3 COOH溶液所得滴定曲线如图: 2.pH— V (图) (1)各特殊点粒子大小关系及变化趋势 (2)各特殊点对水电离程度的影响 [例] 常温下,用0.05 mol·L -1 NaOH溶液分别滴定10.00 mL 浓度均为...
 [注解与辨疑j] pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明 作者:化学自习室 来源:未知 日期:2024-08-20 16:09:24 点击:490 所属专题:ph计算
[注解与辨疑j] pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明 作者:化学自习室 来源:未知 日期:2024-08-20 16:09:24 点击:490 所属专题:ph计算
问题呈现:pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明。 错解:由pH=5,知 c (H + )=10 -5 mol/L, 加水冲稀1000倍后, 由盐酸产生的 c (H + )=10 -8 mol/L, 由水产生的 c (H + )=10 -7 mol/L, 所以溶液总的 c (H + )=10 -8 mol/L + 10 -7 m...
 [注解与辨疑j] 为什么多元弱酸的各级电离常数逐级减少? 作者:化学自习室 来源:未知 日期:2024-08-20 15:58:48 点击:1045 所属专题:电离平衡常数
[注解与辨疑j] 为什么多元弱酸的各级电离常数逐级减少? 作者:化学自习室 来源:未知 日期:2024-08-20 15:58:48 点击:1045 所属专题:电离平衡常数
多元弱酸是分步电离的,且以第一步电离为主,各级电离常数逐级减少,且相差很大。 对于这个问题,有人这样解释,你看看有没有毛病? 根据电离平衡移动理论,多元弱酸第一步电离产生了氢离子,氢离子浓度增加会抑制第二步电离以及后续的电离过程,使得K 1 K 2 K 3 。 有人还...
 [注解与辨疑j] 常见双水解反应的总结 作者:化学自习室 来源:未知 日期:2024-08-08 17:04:33 点击:1120 所属专题:双水解反应
[注解与辨疑j] 常见双水解反应的总结 作者:化学自习室 来源:未知 日期:2024-08-08 17:04:33 点击:1120 所属专题:双水解反应
弱酸根离子与弱碱阳离子在水溶液中 不能 大量 共存 的情况常见的有:...
 [注解与辨疑j] 为什么pH的p是小写? 作者:化学自习室 来源:未知 日期:2024-07-25 09:04:01 点击:873 所属专题:pH
[注解与辨疑j] 为什么pH的p是小写? 作者:化学自习室 来源:未知 日期:2024-07-25 09:04:01 点击:873 所属专题:pH
pH值表示的是溶液中氢离子浓度的负对数,具体来说是溶液中氢离子(H)活度的负对数。其数学表达式为: pH=log[H + ] 有时候写快了写成了pH然后在学术委员会会经常揪出这个小错误。理解了背后的含义pH就不会出错。 “p”表示负对数:在化学中,小写字母“P”通常表示“负对数...
 [注解与辨疑j] 不同氧化数金属离子的存在形式 作者:化学自习室 来源:未知 日期:2024-07-15 09:40:26 点击:566 所属专题:过渡金属
[注解与辨疑j] 不同氧化数金属离子的存在形式 作者:化学自习室 来源:未知 日期:2024-07-15 09:40:26 点击:566 所属专题:过渡金属
过渡金属具有多变的氧化数,因为次外层d电子可以部分或者全部参与成键,因此它们能形成从+2开始逐渐升高的氧化数。 一、不同氧化数金属离子的存在形式 但是这些不同氧化数(价态)的离子是怎么存在的呢?简单离子? 例如, 金属钒,价电子构型3d34s2, 常见氧化态+2、+3...
 [注解与辨疑j] 拉平效应和区分效应 作者:化学自习室 来源:未知 日期:2024-01-16 08:29:58 点击:955 所属专题:酸性
[注解与辨疑j] 拉平效应和区分效应 作者:化学自习室 来源:未知 日期:2024-01-16 08:29:58 点击:955 所属专题:酸性
HCI、HI、HNO 3 、HClO 4 等强酸在水中“完全电离”,因而它们同浓度水溶液的pH相同,这意味着它们酸的强度是相同的。然而,这些强酸结构中与可电离氢原子结合的化学键并不相同,为什么电离能力相同呢? 我们不能忘记,酸在水中电离出氢离子是与水分子作用的结果: 强酸在...
 [注解与辨疑j] 为什么强酸在冰醋酸中可以比较出其酸性强弱? 作者:化学自习室 来源:未知 日期:2024-01-16 08:00:01 点击:913 所属专题:酸性
[注解与辨疑j] 为什么强酸在冰醋酸中可以比较出其酸性强弱? 作者:化学自习室 来源:未知 日期:2024-01-16 08:00:01 点击:913 所属专题:酸性
问:为什么强酸在冰醋酸中可以比较出其酸性强弱? 想要回答这个问题,还是得回到酸电离的机理上。涉及到溶剂的区分和 拉平效应 。 以在水溶液中的弱酸醋酸为例: CH 3 COOH+H 2 O CH 3 COO - +H 3 O + 醋酸分子在水中发生电离的时候,其实是醋酸分子和水分子之间发生反...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切相关,但二...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子...
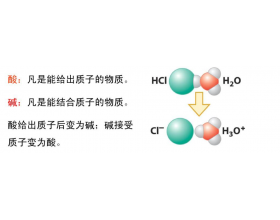
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子 (H ) 的物质 ; 碱是 ...
电离概念是中学一个基本概念,用以区分电解质和非电解质、共价化合物和离子化合物。其...
1. 如何理解 “ 水解 ” 反应的概念? “ 水解 ” ,顾名思义,可理解为 “ 某物质遇...
为什么NaHCO 3 溶液能与Na[Al(OH) 4 ]溶液反应? NaHSO 3 溶液之所以能与Na[Al(OH) 4 ...
双水解程度计算: 同样是双水解,为什么CH 3 COO - 和 NH 4 + 可以大量共存,而Al 3...
我们在看到酸碱中和滴定图像时,看到反应一半点处图像很平缓,这是因为这一部分成分构...