
|
学习小专题 |

|
学习小专题 |
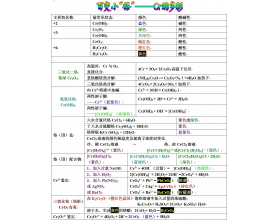 [注解与辨疑j] 百变小“铬”——Cr的多彩 作者:淮畔化学 来源:未知 日期:2020-02-15 13:02:41 点击:766 所属专题:重铬酸钾 颜色
[注解与辨疑j] 百变小“铬”——Cr的多彩 作者:淮畔化学 来源:未知 日期:2020-02-15 13:02:41 点击:766 所属专题:重铬酸钾 颜色
...
 [注解与辨疑j] 电离度的概念和应用 作者:化学自习室 来源:未知 日期:2019-11-15 22:46:55 点击:9907 所属专题:电离度
[注解与辨疑j] 电离度的概念和应用 作者:化学自习室 来源:未知 日期:2019-11-15 22:46:55 点击:9907 所属专题:电离度
(1) 电离度(α) ①电离度定义式:弱电解质在水溶液中达成电离平衡时 N、 n 、C分别代表电解质的分子个数、物质的量和物质的量浓度。 (2) 影响电离度的外因 ①温度。弱电解质的电离多为吸热过程(少数例外,如HF、 H 2 SO 3 、H 3 PO 4 电离放热),升高温度,电离度增大。...
 [注解与辨疑j] 电离平衡常数的概念和应用 作者:化学自习室 来源:未知 日期:2019-11-15 11:04:53 点击:22162 所属专题:电离平衡常数
[注解与辨疑j] 电离平衡常数的概念和应用 作者:化学自习室 来源:未知 日期:2019-11-15 11:04:53 点击:22162 所属专题:电离平衡常数
一、电离平衡常数概念及影响因素 在可溶性弱电解质AB A + +B - 达到电离平衡时有: K = ( K 为电离平衡常数)。 在电离度α<5%的情况下,可 推出α= (稀释定律)。 K 值大小主要由弱电解质本性决定,随温度不同而稍有不同,与弱电解质浓度无关。 二、电离常数的某些应用...
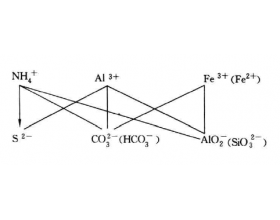 [注解与辨疑j] 完全双水解反应示意图 作者:化学自习室 来源:未知 日期:2019-11-15 10:52:59 点击:1239 所属专题:双水解反应
[注解与辨疑j] 完全双水解反应示意图 作者:化学自习室 来源:未知 日期:2019-11-15 10:52:59 点击:1239 所属专题:双水解反应
...
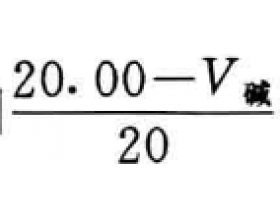 [注解与辨疑j] 滴定突跃与指示剂的选择 作者:化学自习室 来源:未知 日期:2019-11-15 10:47:52 点击:5964 所属专题:指示剂选择
[注解与辨疑j] 滴定突跃与指示剂的选择 作者:化学自习室 来源:未知 日期:2019-11-15 10:47:52 点击:5964 所属专题:指示剂选择
(1)强酸与强碱的互相滴定 [例] 用0.1 mol L -1 的NaOH标准溶液滴定20 mL0. 1 mol L -1 的盐酸时,如果滴定误差在±0.1%以内,反应完毕后溶液的pH值范围是多少? [解析]当滴入20. 00 mL NaOH溶液时恰好达到等量点, 此时溶液pH = 7。当滴定误差为-0.1%时,滴入的NaOH...
 [注解与辨疑j] 碳酸根离子与金属离子反应分析 作者:化学自习室 来源:未知 日期:2020-02-15 11:16:59 点击:14529 所属专题:双水解反应
[注解与辨疑j] 碳酸根离子与金属离子反应分析 作者:化学自习室 来源:未知 日期:2020-02-15 11:16:59 点击:14529 所属专题:双水解反应
C O 3 2 - 与M n+ 在水溶液中的水解反应式为: C O 3 2 - +H 2 O HC O 3 - +OH - M n+ +H 2 O [M(OH)] (n-1)+ +H + 当将C O 3 2 - 与M 2+ 两种溶液混和,可能存在如下多重平衡: MCO 3 +M(OH) 2 M 2 (OH) 2 CO 3 根据MCO 3、 M(OH) 2 的溶解度不同,可得...
 [注解与辨疑j] 使用酸碱指示剂应注意哪些问题? 作者:化学自习室 来源:未知 日期:2019-11-11 17:16:54 点击:2685 所属专题:酸碱指示剂
[注解与辨疑j] 使用酸碱指示剂应注意哪些问题? 作者:化学自习室 来源:未知 日期:2019-11-11 17:16:54 点击:2685 所属专题:酸碱指示剂
(1)温度 温度不同指示剂的离解常数和变色范围也随之变 动。如甲基橙18℃时变色范围为3. 14. 4, 100 ℃ 时为2. 53.7,因此选择指示剂应注意操作温度。盐类存在能使指示剂离解常数 和变色范围发生移动,因此测定某溶液PH值不要混入不相关盐类。 , (2) 指示剂本身是有机弱...
 [注解与辨疑j] 共价键极性强弱与电解质强弱是否一致? 作者:化学自习室 来源:未知 日期:2019-11-11 16:55:15 点击:1350 所属专题:弱电解质判断 键的极性
[注解与辨疑j] 共价键极性强弱与电解质强弱是否一致? 作者:化学自习室 来源:未知 日期:2019-11-11 16:55:15 点击:1350 所属专题:弱电解质判断 键的极性
从物质结构观点来看,电解质一定是离子化合物或含极性键 的共价化合物。对于后者,电解质的强弱与共价键的极性虽有一 定的联系,但绝不能得出共价键极性越强,电解质就越强的结论。 仅举下列事实加以说明: (1) 含有强极性键的非电解质 乙醇、蔗糖均含极强极性的O—H键,NH...
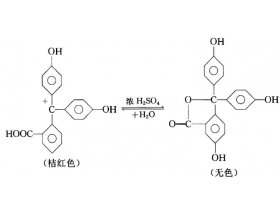
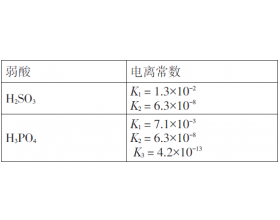 [注解与辨疑j] 定量分析弱酸酸式盐溶液酸碱性问题 作者:化学自习室 来源:未知 日期:2019-10-30 15:09:24 点击:1253 所属专题:酸碱性判断 酸式盐
[注解与辨疑j] 定量分析弱酸酸式盐溶液酸碱性问题 作者:化学自习室 来源:未知 日期:2019-10-30 15:09:24 点击:1253 所属专题:酸碱性判断 酸式盐
表2 几种弱酸的电离常数(25 ℃) 例3 常温下,0.1mol·L -1 NaHSO 3 溶液呈( )(填“酸性”“中性”或“碱性”)? 分析: HS O 3 - +H 2 O H 2 SO 3 +OH - 使溶液呈碱性 HS O 3 - S O 3 2 - +H + 使溶液呈酸性 溶液的酸碱性取决于水解占主要的,还是电离占主要...
 [注解与辨疑j] 常见的强电解质与弱电解质 作者:化学自习室 来源:未知 日期:2019-08-26 19:17:19 点击:2914 所属专题:弱电解质
[注解与辨疑j] 常见的强电解质与弱电解质 作者:化学自习室 来源:未知 日期:2019-08-26 19:17:19 点击:2914 所属专题:弱电解质
常见的强电解质: 强酸:HCl、HBr、HI、H 2 SO 4 、HNO 3 、HClO 3 、HClO 4 等。 强碱:NaOH、KOH、Ba(OH) 2 、Ca(OH) 2 等。 多数盐NaCl、(NH 4 ) 2 SO 4 、Fe(NO 3 ) 3 、BaSO 4 等。 常见的弱电解质: 弱酸:HF、HClO、H 2 S、H 2 SO 3 、H 3 PO 4 、H 2 CO 3 、CH 3 COOH...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切相关,但二...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子 (H ) 的物质 ; 碱是 ...
电离概念是中学一个基本概念,用以区分电解质和非电解质、共价化合物和离子化合物。其...
1. 如何理解 “ 水解 ” 反应的概念? “ 水解 ” ,顾名思义,可理解为 “ 某物质遇...
为什么NaHCO 3 溶液能与Na[Al(OH) 4 ]溶液反应? NaHSO 3 溶液之所以能与Na[Al(OH) 4 ...
双水解程度计算: 同样是双水解,为什么CH 3 COO - 和 NH 4 + 可以大量共存,而Al 3...
我们在看到酸碱中和滴定图像时,看到反应一半点处图像很平缓,这是因为这一部分成分构...