
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【导读】HF的“弱”仅体现在H⁺电离能力弱,提供质子的能力有限,但其“强”在于F⁻的强化学反应活性。这种强腐蚀性不依赖H⁺浓度,而是通过F⁻高度的反应活性、螯合能力和HF分子的小尺寸和强渗透性破坏物质的结构。
氟离子(F⁻)的独特反应性:强螯合能力,结合Ca²⁺、Mg²⁺能力特别强;形成[SiF₆]²⁻,溶解硅基材料;与金属形成氟络合物,破坏金属钝化膜。
HF分子的特性:小分子尺寸和形成氢键能力导致其渗透性极强,而弱酸性会延迟疼痛和伤害,增加其危险性。
综合叠加效应:F⁻的深度化学破坏与HF的深度物理渗透组合,远超其酸强度预期的极端腐蚀性和生物毒性。

一、强腐蚀性的主要原因与机理
HF是一种弱酸,pKa=3.17,在水中不完全电离,但其腐蚀性极强,尤其对含硅材料(如玻璃、硅片)和生物组织具有特殊破坏性。
1.氟离子的强配位能力和高电负性
溶解硅酸盐(玻璃腐蚀):HF能腐蚀玻璃、陶瓷等含SiO₂或硅酸盐的材料。因此HF用于蚀刻玻璃(如温度计刻度、艺术品)、清洗金属表面的硅垢。
F⁻与硅(Si)形成非常稳定的六氟硅酸根离子[SiF₆]²⁻,破坏Si-O骨架。生成的SiF₄是气体,会脱离反应体系,促使反应持续进行,因此HF能快速腐蚀玻璃、陶瓷等材料,这是其他酸(如盐酸、硫酸)无法实现的。
SiO₂(s)+4HF(aq)=SiF₄(g)+2H₂O(l)
SiF₄(g)+2HF(aq)=H₂SiF₆(aq)(六氟硅酸,可溶)
2.HF分子的强渗透性与弱酸性解离
生物组织深度腐蚀与剧痛:HF接触皮肤时,因弱酸性使得初始刺痛感可能轻微,但会造成深部组织坏死。HF烧伤即使面积很小,哪怕是一个指尖,若不及时用钙剂(如葡萄糖酸钙凝胶)中和,可导致深部坏死、骨侵蚀甚至致命。
Ca²⁺+2F⁻=CaF₂↓
Mg²⁺+2F⁻=MgF₂↓
渗透性:HF分子小且具有氢键能力,能快速穿透皮肤角质层和细胞膜。
细胞内解离:HF进入组织后,HF在细胞内解离出F⁻,细胞内部pH接近中性,有利于HF解离。
钙镁螯合:F⁻与细胞内的Ca²⁺、Mg²⁺形成难溶性盐,如CaF₂,MgF₂,导致生物正常功能严重受损。
①低钙血症、低镁血症:扰乱神经、肌肉功能和细胞信号传导。
②细胞死亡:关键酶(如Na⁺、K⁺-ATP酶)因失去必需的Mg²⁺辅因子而失活。
③钾离子泄漏:细胞膜完整性破坏,K⁺外流引起剧痛和心律失常风险。
④组织液化坏死:F⁻持续破坏细胞结构和蛋白。
3.对金属的腐蚀
除了H⁺的氧化作用(酸腐蚀性),F⁻能溶解金属表面的钝化膜,如铝的Al₂O₃、不锈钢的Cr₂O₃,形成可溶性氟络合物,加速腐蚀。因此HF可用于清洗金属,如不锈钢、钛合金表面的氧化物。HF-HNO₃混合酸用于不锈钢的“酸洗”,去除氧化皮,其中HF专门溶解铬氧化物层。
不锈钢耐HCl、H₂SO₄等酸,但会因HF的独特性而失效。不锈钢中的Cr³⁺在HCl中形成不溶性CrCl₃保护层,但在HF通过溶解Cr₂O₃钝化膜并络合金属离子,形成可溶性[CrF₆]³⁻,阻止钝化膜修复。此外HF分子小,可渗入钝化膜微裂纹加速破坏。
Cr₂O₃(s)+6HF(aq)=2CrF₃(aq)+3H₂O(l)
Fe₂O₃(s)+6HF(aq)=2FeF₃(aq)+3H₂O(l)
NiO(s)+2HF(aq)=NiF₂(aq)+H₂O(l)
HF对铝的腐蚀同样具有很强的腐蚀性。
2Al+6HF=2AlF₃+3H₂↑
Al₂O₃+6HF=2AlF₃+3H₂O
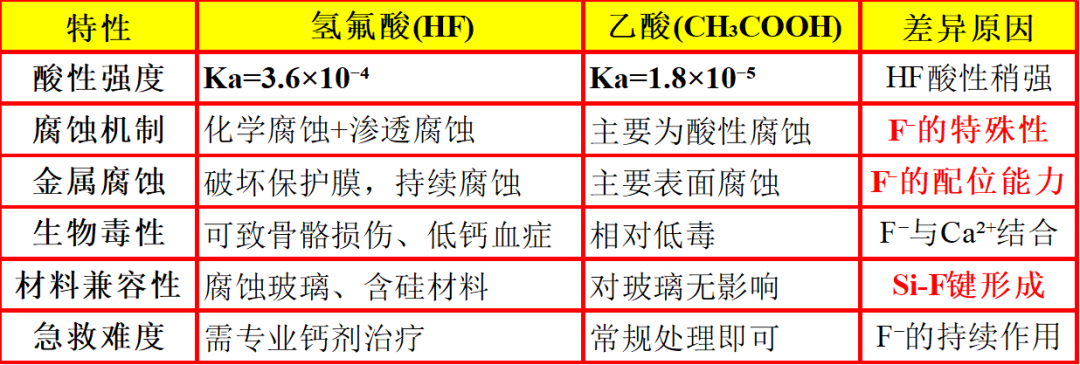
二、对比强酸,为何HF“弱酸”却腐蚀性强?
对比强酸(如HCl,H₂SO₄):主要靠高H⁺浓度进行质子化腐蚀(如水解蛋白质、溶解碳酸盐),作用相对“表面”,疼痛感剧烈且立即。
HF:H⁺浓度低,初始腐蚀慢、疼痛感延迟(危险!易被忽视)。核心破坏力来自F⁻,F⁻通过深度渗透、螯合关键离子(Ca²⁺、Mg²⁺)、溶解硅、钝化膜、形成稳定络合物加上HF的小体积渗透性,造成深层、持续、系统性的破坏。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、氟元素:卤族之首的 “极端化学明星”—— 发现与本质 氟...
氢卤酸(HX,X = F、Cl、Br、I)的酸性强弱顺序为:HI HBr HCl HF。以...
HF、HCl、HBr、HI的水溶液分别叫氢氟酸、氢氯酸(盐酸)、氢溴酸、...
1.为什么碱金属单质的熔点随着原子序数增大而降低,而卤素单...
1.卤素单质间的相互置换问题 先请大家判断下列说法是否正确。...
一、氯的含氧酸的种类、氧化数、结构 氯的含氧酸目前有次氯酸...