
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氟化氢(HF)中的氢键是其物理和化学性质的重要影响因素。以下是对其氢键特性的详细分析:
1. 氢键的形成
电负性差异:氟(F)是电负性最强的元素,与氢(H)形成强极性共价键(H–F),导致H带显著正电荷(δ+),F带负电荷(δ−)。
氢键本质:相邻HF分子中,带正电的H与另一分子带负电的F通过静电吸引形成F–H···F氢键。
2. 氢键的结构特征
链状排列:在液态或固态HF中,氢键将多个分子连接成锯齿形链状结构如图:
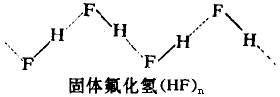 (注意不是直线吆)
(注意不是直线吆)
这种结构在固态中尤为明显,形成无限延伸的链。
协同效应:氢键的强度可能因邻近氢键的存在而增强,进一步稳定分子排列。
3. 氢键的强度
强于其他氢键:F–H···F的键能约为 25–40 kJ/mol,显著强于水(O–H···O,约20 kJ/mol)或氨(N–H···N,约5–10 kJ/mol)中的氢键。
原因:F的小原子半径和高电负性导致更强的静电相互作用。
4. 对物理性质的影响
异常高的沸点:HF的沸点为19.5°C,远高于同族其他氢化物(如HCl沸点-85°C),归因于氢键大幅增强分子间作用力。
高粘度与溶解性:液态HF因链状结构呈现高粘度,并能通过氢键溶解许多离子化合物(如金属氟化物)。
5. 与其他物质的对比
与水(H₂O)的差异:尽管单个F–H···F氢键强于O–H···O,但水的沸点更高(100°C),因为每个H₂O分子可形成4个氢键(三维网络),而HF每个分子仅形成2个氢键(一维链状),整体网络强度较低。
6. 化学性质的影响
弱酸性:HF为弱酸(pKa≈3.17),部分归因于氢键稳定化作用。浓溶液中,HF可能以多聚体(如(HF)₆)形式存在,抑制电离。
氟硅酸生成:HF与SiO₂反应生成挥发性SiF₄,常用于玻璃蚀刻,氢键影响其反应活性。
总结:
氟化氢中的氢键是其独特性质的核心,从分子结构到宏观行为均受其支配。理解这些氢键的强度、排列方式及其对物化性质的影响,对材料科学和化学工业(如氟化物合成、蚀刻工艺)具有重要意义。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
具有很强的氧化性,不同于硝酸根。这种氧化性甚至比硝酸根更...
一、氟元素:卤族之首的 “极端化学明星”—— 发现与本质 氟...
氢卤酸(HX,X = F、Cl、Br、I)的酸性强弱顺序为:HI HBr HCl HF。以...
HF、HCl、HBr、HI的水溶液分别叫氢氟酸、氢氯酸(盐酸)、氢溴酸、...
1.为什么碱金属单质的熔点随着原子序数增大而降低,而卤素单...
1.卤素单质间的相互置换问题 先请大家判断下列说法是否正确。...