
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氢氟酸是一弱酸(298K时,Ka=3.5×10-4)。与其它弱酸相同,浓度越稀,HF电离度越大。但溶液浓度增大时,HF2-离子增多。因为在氢氟酸溶液尤其是浓溶液中,一部分F-离子通过氢键与未离解的HF分子形成缔合离子,如HF2-、H2F3-、H3F4-等,其中HF2-离子特别稳定。
HF + F- ![]() HF2- K=5.1
HF2- K=5.1
稀溶液: HF + H2O![]() H3O++ F- Ka=3.5×10-4
H3O++ F- Ka=3.5×10-4
浓溶液: 2HF + H2O![]() H3O++ HF2-
H3O++ HF2-
HF2-离子是一弱碱,比水合F-离子稳定,使上式平衡向右移动从而使氢氟酸的电高度增大。当浓度大干5mol·L-1时,氢氟酸已经是相当强的酸。用碱中和氢氟酸溶液能生成酸式盐如KHF2也说明HF2-离子的稳定性。
氢氟酸的另一个特殊性质是它能与二氧化硅或硅酸盐反应生成气态SiF4。
SiO2+ 4HF ![]() SiF4+ 2H2O
SiF4+ 2H2O
CaSiO3+ 6HF ![]() CaF2+ SiF4+ 3H2O
CaF2+ SiF4+ 3H2O
液态氟化氢有微弱的自偶电离:
2HF![]() H2F++ F- K≈10-10
H2F++ F- K≈10-10
它的介电常数(84)和水(81)相仿,是一种有用的溶剂,能溶解很多无机物和有机物。
氟化氢是极性分子,在293K时能无限制地溶于水中,原因是它同水形成氢键。氟化氢的水溶液称为氢氟酸。
氟化氢的熔点、沸点和气化热特别高是因为其分子间存在氢键的缘故。实验证明,氟化氢在气态、液态和固态时都通过氢键形成不同程度的缔合。在360K以上它的蒸气密度相当于HF,在299K时相当于(HF)2和(HF)3的混合物。在固态时,氟化氢由无限长的锯齿形长链组成。
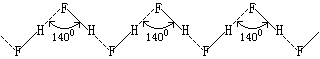

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
HF、HCl、HBr、HI的水溶液分别叫氢氟酸、氢氯酸(盐酸)、氢溴酸、...
次氯酸的酸性不强,却有很强的氧化性、漂白性,次氯酸的氧化...
一、HNO 3 为什么不能氧化Cl - ? 硝酸HNO 3 是强氧化剂,Cl - 氯...
氢氟酸是一弱酸(298K时,Ka=3.5×10 -4 )。与其它弱酸相同,浓度越...
卤素是很活泼的非金属元素。单质最典型的化学性质是强氧化性...
F Cl Br I ,卤素,第 Ⅶ A 族, 价电子构型 ns 2 np 5 虽然是同一族...